Salze
 Arzneimittelgruppen / HilfsstoffeSalze bestehen aus negativ und positiv geladenen Atomen oder Verbindungen, also aus Anionen und Kationen. Sie haben in der Pharmazie eine grosse Bedeutung als Wirk- und Hilfsstoffe.
Arzneimittelgruppen / HilfsstoffeSalze bestehen aus negativ und positiv geladenen Atomen oder Verbindungen, also aus Anionen und Kationen. Sie haben in der Pharmazie eine grosse Bedeutung als Wirk- und Hilfsstoffe.synonym: Sal, Salts, Ionische Verbindungen
ProdukteZahlreiche Wirkstoffe und pharmazeutische Hilfsstoffe liegen in Arzneimitteln als Salze vor. Sie sind auch in Nahrungsergänzungsmitteln, in Lebensmitteln, Medizinprodukten und Kosmetika enthalten. Als Offenware sind verschiedene Salze in Apotheken und Drogerien erhältlich.
StrukturSalze bestehen aus positiv und negativ geladenen Atomen oder Verbindungen, also aus Ionen (Kationen und Anionen). Sie bilden zusammen die ionische Bindung (Ionenbindung) aus, die auf der elektrostatischen Anziehung beruht. Der bekannteste Vertreter ist das Speisesalz Natriumchlorid (NaCl), das aus dem Kation Natrium (Na+) und dem Anion Chlorid (Cl-) aufgebaut ist. Neben Natriumchlorid existieren unzählige andere anorganische und organische Salze (siehe unten). Der Grund für die ionische Bindung liegt in den unterschiedlichen Elektronegativitäten der Atome. So hat Natrium eine geringe Elektronegativität (es zieht Elektronen kaum an) und Chlor hat eine hohe Elektronegativität (zieht Elektronen an).
Natriumchlorid, zum Vergrössern anklicken. Foto © PharmaWiki
Metallionen sind in der Regel Kationen und Nichtmetalle bilden Anionen. Beide können ein- oder mehratomig sein. Die Ionen können nicht nur einfach, sondern auch mehrfach geladen sein. Weil sich die Ladungen ausgleichen, ist ein Salz von aussen betrachtet neutral.
In den sogenannten Ionenkristallen ordnen sich die Ionen in einer typischen Gitterstruktur an. Im Salzkristall ist jedes Ion von 6 Gegenionen umgeben. Die Festigkeit der Kristalle beruht auf der elektrostatischen Anziehung der Ionen untereinander. Da diese stark ist, haben sie hohen Schmelzpunkte und Siedepunkte (siehe unten).
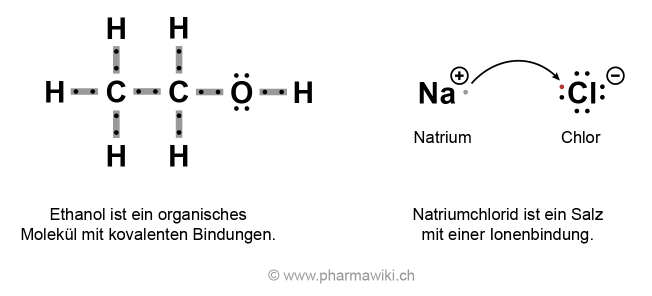
Salze unterscheiden sich von den Molekülen, die ungeladen sind und die sich durch kovalente Bindungen auszeichnen. Die Atome in Molekülen teilen ihre Elektronen miteinander.
Moleküle und Salze, zum Vergrössern anklicken. Illustration © PharmaWiki
EigenschaftenSalze sind häufig, wenn auch nicht immer, gut in Wasser löslich. Ein Beispiel für ein schlecht lösliches Salz ist Calciumcarbonat (Kalk). In Lösung oder im geschmolzenen Zustand sind sie gute elektrische Leiter, nicht jedoch als Kristalle.
Salze liegen oft als weisse oder transparente und kristalline Feststoffe wie Natriumchlorid vor, können jedoch in jeder Farbe vorkommen. So ist beispielsweise Kaliumpermanganat violett und Kupfersulfat blau. Der Schmelzpunkt ist typischerweise hoch. Er liegt für Natriumchlorid bei 801 °C. Im Unterschied zum Haushaltszucker (Saccharose), einem organischen Molekül, schmilzt und verbrennt Salz auf der Herdplatte deshalb nicht, wenn es verschüttet wird. Magnesiumoxid hat sogar einen Schmelzpunkt von über 2800 °C. Dies gilt entsprechend auch für die Siedepunkte.
Salze entstehen zum Beispiel bei der Reaktion einer Säure mit einer Base (Säure-Base-Reaktionen). Im Folgenden ist ein Beispiel dargestellt:
- NaOH (Natriumhydroxid) + HCl (Salzsäure) → NaCl (Natriumchlorid) + H2O (Wasser)
Metalle übertragen Elektronen auf Nichtmetalle (siehe unter Redox-Reaktionen):
- 2 Mg: (Magnesium elementar) + O2 (Sauerstoff) → 2 MgO (Magnesiumoxid)
Es existieren weitere Reaktionen und Salze kommen auch in der Natur vor, wo sie abgebaut oder mit einer anderen Methode gewonnen werden können.
AnwendungsgebieteIn der Pharmazie:
- Als pharmazeutische Wirkstoffe und Hilfsstoffe, für Nahrungsergänzungsmittel.
- Für die Herstellung von → Wirkstoffsalzen.
- Für die Herstellung von Magistralrezepturen.
Im Folgenden sind einige Beispiele von Salzen dargestellt, die in der Pharmazie von Bedeutung sind (Auswahl):
- Bariumsulfat
- Bismutsubsalicylat
- Bittersalz (Magnesiumsulfat)
- Glaubersalz (Natriumsulfat)
- Hirschhornsalz (Ammoniumhydrogencarbonat)
- Kaliumbromid
- Kaliumcarbonat
- Kaliumchlorat (keine medizinische Anwendung mehr!)
- Kaliumchlorid
- Kaliumdihydrogenphosphat
- Kaliumhydrogencarbonat
- Kaliumiodid
- Kaliumnitrat (Salpeter)
- Kaliumpermanganat
- Katarrhlösende Salzmischung
- Kupfersulfat
- Natriumascorbat (Natriumsalz von Vitamin C)
- Natriumbenzoat
- Natriumcarbonat (Soda)
- Natriumchlorat (keine medizinische Anwendung!)
- Natriumchlorid (Speisesalz)
- Natriumcitrat
- Natriumdihydrogenphosphat
- Natriumfluorid
- Natriumhydrogencarbonat (Natron)
- Natriummonohydrogenphosphat
- Salze von Säuren (z.B. Acetate, Citrate)
- Seifen (Salze von Fettsäuren)
Ionen, Moleküle, Wirkstoffsalze, Natriumchlorid, Säuren, Polarität
Literatur- Arzneimittel-Fachinformation (CH)
- Europäisches Arzneibuch PhEur
- Fachliteratur
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.