Wasser
 HilfsstoffeWasser (H2O) liegt als klare, farblose Flüssigkeit ohne Geruch und Geschmack vor. Es ist eine anorganische Verbindung, die aus einem Sauerstoffatom aufgebaut ist, das mit zwei Wasserstoffatomen kovalent verbunden ist. Wasser ist polar und trägt partiell positive und negative Ladungen. Die ermöglicht ihm die Ausbildung von Wasserstoffbrücken und die Lösung zahlreicher Substanzen. Es hat deshalb auch einen vergleichsweise hohen Schmelzpunkt von 0 °C und Siedepunkt von 100 °C. Im Unterschied zu vielen anderen Substanzen ist die Dichte des Festkörpers geringer als diejenige der Flüssigkeit, weshalb Eis auf Wasser schwimmt. Wasser ist für das Leben auf unserem Planeten essenziell und keine andere Verbindung kommt auf ihm häufiger vor. So besteht beispielsweise der menschliche Körper zu etwa 60 % aus Wasser. In der Pharmazie ist Wasser das wichtigste Lösungsmittel und wird unter anderem für die Herstellung flüssiger, halbfester und fester Darreichungsformen und als Extraktionsmittel verwendet. Wasser hat keine GHS-Gefahrstoffkennzeichnung, aber es ist nicht ungefährlich. So kann es beispielsweise mit Krankheitserregern und Schadstoffen verunreinigt sein und Verbrennungen und Erfrierungen verursachen.
HilfsstoffeWasser (H2O) liegt als klare, farblose Flüssigkeit ohne Geruch und Geschmack vor. Es ist eine anorganische Verbindung, die aus einem Sauerstoffatom aufgebaut ist, das mit zwei Wasserstoffatomen kovalent verbunden ist. Wasser ist polar und trägt partiell positive und negative Ladungen. Die ermöglicht ihm die Ausbildung von Wasserstoffbrücken und die Lösung zahlreicher Substanzen. Es hat deshalb auch einen vergleichsweise hohen Schmelzpunkt von 0 °C und Siedepunkt von 100 °C. Im Unterschied zu vielen anderen Substanzen ist die Dichte des Festkörpers geringer als diejenige der Flüssigkeit, weshalb Eis auf Wasser schwimmt. Wasser ist für das Leben auf unserem Planeten essenziell und keine andere Verbindung kommt auf ihm häufiger vor. So besteht beispielsweise der menschliche Körper zu etwa 60 % aus Wasser. In der Pharmazie ist Wasser das wichtigste Lösungsmittel und wird unter anderem für die Herstellung flüssiger, halbfester und fester Darreichungsformen und als Extraktionsmittel verwendet. Wasser hat keine GHS-Gefahrstoffkennzeichnung, aber es ist nicht ungefährlich. So kann es beispielsweise mit Krankheitserregern und Schadstoffen verunreinigt sein und Verbrennungen und Erfrierungen verursachen. synonym: H2O, HOH, Dihydrogenmonoxid, Aqua, Water, Eau, Acqua
ProdukteWasser ist in verschiedenen Qualitäten im Handel. Wasser für pharmazeutische Zwecke ist in Apotheken verfügbar, zum Beispiel das gereinigte Wasser (siehe dort). Es wird in Apotheken hergestellt oder bei spezialisierten Lieferanten bestellt.
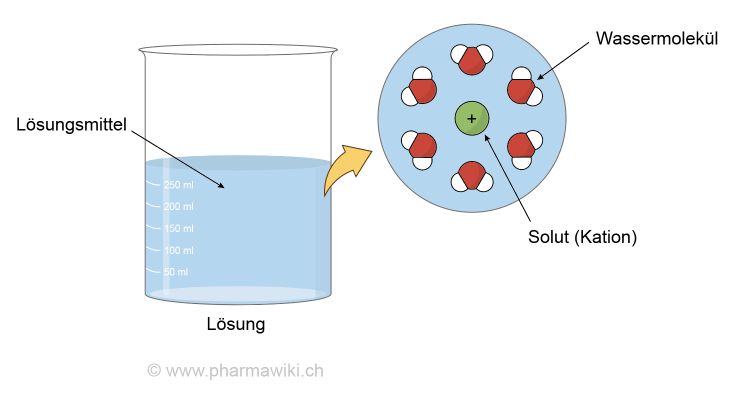
Wässrige Lösung, zum Vergrössern anklicken. Illustration © PharmaWiki
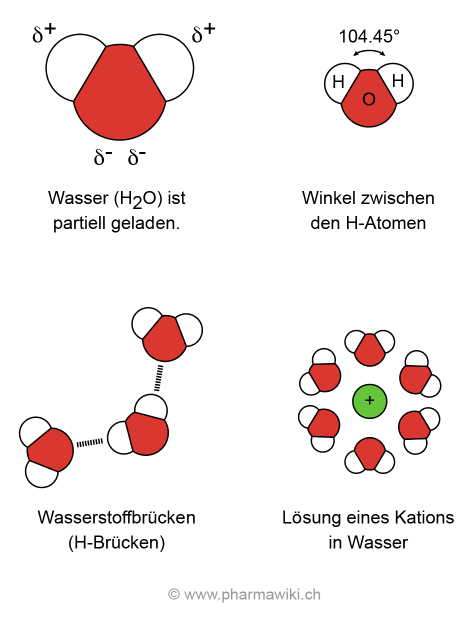
StrukturReines Wasser (H2O, Mr = 18.015 g/mol) liegt als klare, farblose Flüssigkeit ohne Geruch und Geschmack vor. Es ist eine anorganische Verbindung, welche aus zwei Atomen Wasserstoff und einem Atom Sauerstoff aufgebaut ist. Die Wasserstoffatome sind kovalent an das Sauerstoffatom gebunden. Der innere Winkel zwischen den Wasserstoffatomen beträgt 104.45°.
Wasser bei Acqucalda, zum Vergrössern anklicken. Foto © PharmaWiki
Eis beim Lukmanierpass, zum Vergrössern anklicken. Foto © PharmaWiki
Polarität, Löslichkeit und WasserstoffbrückenWasser zeichnet sich durch seine Polarität aus, was die Lösung zahlreicher Substanzen ermöglicht, zum Beispiel von Salzen und polaren Verbindungen. Der Sauerstoff (O) ist partiell negativ (δ-) und der Wasserstoff (H) partiell positiv (δ+) geladen.
Die Wasserlöslichkeit der meisten Stoffe nimmt mit steigender Temperatur zu. Deshalb wird Wasser zum Beispiel für die Zubereitung von Tees und Kaffee und als Reinigungsmittel erwärmt. Es gibt jedoch Ausnahmen, zum Beispiel Calciumsulfat (Gips).
Wasser kann maximal vier Wasserstoffbrückenbindungen ausbilden. Weil es sowohl ein Donor als auch ein Akzeptor für die H-Brücken ist, hat es einen vergleichsweise hohen Schmelzpunkt von 0°C und einen Siedepunkt von 100°C (Normdruck). Bei einem geringeren Druck, zum Beispiel in den Alpen, sinkt der Siedepunkt.
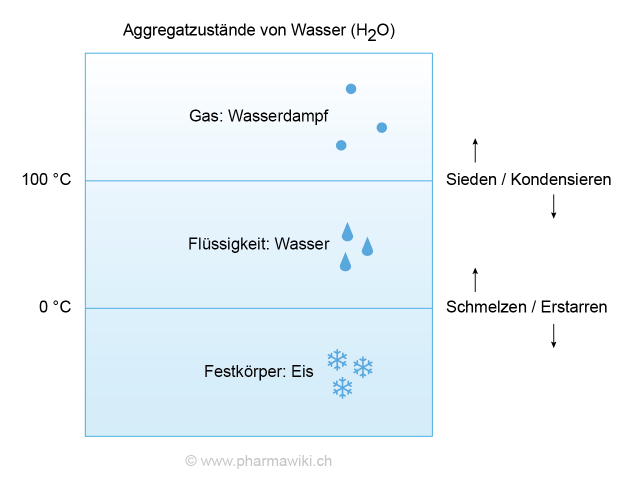
Aggregatzustände von Wasser, zum Vergrössern anklicken. Illustration © PharmaWiki
Es kommt auf der Erde in allen drei Aggregatzuständen vor, nämlich als Eis (Festkörper), Wasser (Flüssigkeit) und als Wasserdampf (Gas). Im flüssigen und festen Zustand sind die Wassermoleküle immer über die Wasserstoffbrücken miteinander in Kontakt.
Eigenschaften von Wasser, zum Vergrössern anklicken. Illustration © PharmaWiki
DichteDie Dichte von Wasser beträgt bei einer Temperatur von 3.98 °C (also etwa 4 °C) und einem Druck von einer Atmosphäre 1000 kg/m3 oder 1 g/cm3. Weil die Dichte von Wasser also 1 g/cm3 ist, entsprechen sich Masse und Volumen. Das Volumen von 1 Liter Wasser entspricht der Masse von 1 kg. Im Unterschied zu vielen anderen Stoffen ist die Dichte des Festkörpers (Eis) etwas geringer als diejenige der Flüssigkeit Wasser. Deshalb schwimmt Eis auf Wasser.
Säure-Base-ReaktionenWasser ist amphoter, d.h. es kann sowohl als Säure (Protonen-Donor) als auch als Base (Protonen-Akzeptor) reagieren:
- H2O (Wasser) + H2O (Wasser) → H3O+ (Oxoniumion) + OH- (Hydroxid)
Reaktive Metalle wie elementares Magnesium reagieren mit Wasser zu Wasserstoff. Dabei handelt es sich um eine Redox-Reaktion. Deshalb kann brennendes Magnesium nicht mit Wasser gelöscht werden!
- Mg: (Magnesium elementar) + H2O (Wasser) → H2 (Wasserstoff) + MgO (Magnesiumoxid)
Bekannt ist auch die heftige Reaktion von elementarem Natrium mit Wasser:
- 2 Na· (Natrium elementar) + 2 H2O (Wasser) → 2 Na+ (Natriumion) + 2 OH− (Hydroxid) + H2 (Wasserstoff)
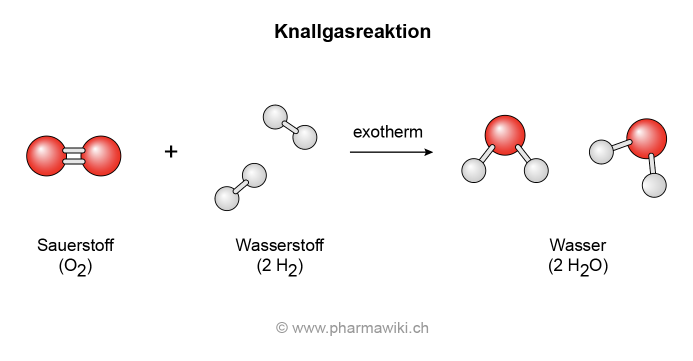
Bei der stark exothermen Reaktion von Wasserstoff und Sauerstoff, der sogenannten Knallgasreaktion, entsteht Wasser:
- 2 H2 (Wasserstoff) + O2 (Sauerstoff) → 2 H2O (Wasser)
Knallgasreaktion mit Sauerstoff und Wasserstoff, zum Vergrössern anklicken. Illustration © PharmaWiki
Wasser und das LebenWasser ist für das Leben auf der Erde unverzichtbar. So besteht der menschliche Körper zu etwa 60 % aus Wasser. Wasser ist das Lösungsmittel für die biochemischen Reaktionen und der Hauptbestandteil der Zellen. Es ist zum Beispiel für den Transport von Sauerstoff, Kohlenstoffdioxid und Nährstoffen im Blut, für die Verdauung und für die Ausscheidung von Fremdstoffen erforderlich. Wasser ist ferner auch ein Substrat für die Photosynthese in Pflanzen:
- 6 CO2 (Kohlenstoffdioxid) + 6 H2O (Wasser) → C6H12O6 (Glucose) + O2 (Sauerstoff)
Das Arzneibuch unterscheidet verschiedene Wasserqualitäten:
- Dazu gehört das gereinigte Wasser (Aqua purificata), das für die Herstellung von Arzneimitteln bestimmt ist, die weder steril noch pyrogenfrei sein müssen. Es wird zum Beispiel mithilfe einer Destillation zubereitet. Dabei wird das Wasser von gelösten Stoffen wie Calciumcarbonat (Kalk) befreit.
- Wasser für Injektionszwecke (Aqua ad iniectabile) wird für die Herstellung von Arzneimitteln verwendet, die zur parenteralen Anwendung vorgesehen sind, also beispielsweise für Infusions- und Injektionspräparate.
- Des Weiteren sind in den Arzneibüchern noch verschiedene weitere Wassersorten beschrieben, z.B. hochgereinigtes Wasser, Wasser zur Herstellung von Extrakten und Wasser als Reagens.
Trinkwasser (Aqua fontana, Aqua potabile) wird nicht vom Arzneibuch, sondern vom Lebensmittelbuch definiert. Es wird nur selten für die Herstellung von Arzneimitteln verwendet. Eine Ausnahme stellt die Zubereitung von Antibiotikasuspensionen für Kinder dar.
Meerwasser (Auqa marina) ist vor allem in befeuchtenden und reinigenden Nasensprays und Nasenspülungen enthalten. Es enthält verschiedene gelöste Salze und hat einen salzigen Geschmack.
AnwendungsgebieteZu den pharmazeutischen Anwendungsgebieten gehören (Auswahl):
- Als pharmazeutischer Hilfsstoff, für die Herstellung und Zubereitung von Arzneimitteln, Medizinprodukten und Körperpflegeprodukten.
- Als Extraktionsmittel und Lösungsmittel.
- Bei einer Dehydratation (Flüssigkeitsmangel), in Form geeigneter Zubereitungen bei einem Blutverlust.
- Durch den Wasserentzug können Pflanzenteile haltbar gemacht werden (Arzneidrogen).
- Als Reinigungsmittel.
- Für chemische Reaktionen, zum Beispiel für die Wirkstoffsynthese.
- Für das Schlucken von peroralen Arzneimitteln.
Hartes Wasser, in welchem unter anderem viele Calcium- und Magnesiumionen gelöst sind, kann Wechselwirkungen mit empfindlichen Wirkstoffen verursachen, zum Beispiel mit Bisphosphonaten und Antibiotika wie den Tetrazyklinen.
Unerwünschte WirkungenWasser hat zwar keine GHS-Gefahrstoffkennzeichnung, ungefährlich ist es aber trotzdem nicht. Es kann abhängig vom Aggregatzustand zum Beispiel zu Erfrierungen, Verbrennungen, zum Ertrinken, Unfällen und Verletzungen führen. Wasser kann mit Mikroorganismen, Parasiten und Schadstoffen verunreinigt sein.
siehe auchGereinigtes Wasser, Wasserdampf, Wasserstoffbrücken, Intermolekulare Wechselwirkungen, Hartes Wasser, Mineralwasser, Eis
Literatur- Europäisches Arzneibuch PhEur
- Fachliteratur
- Lehrbücher der Chemie
- Lehrbücher der Lebensmitteltechnologie
- Pharmacopoea Helvetica
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.