Säuren
 PharmaWikiSäuren sind, mit Ausnahme der Lewis-Säuren, chemische Verbindungen, die ein Proton (H+) auf eine Base übertragen können. Typische Vertreter sind zum Beispiel die Salzsäure, die Schwefelsäure, die Zitronensäure und die Essigsäure. Säuren haben ätzende, reizende und antimikrobielle Eigenschaften. Sie haben in der Pharmazie als Wirkstoffe, Hilfsstoffe und für die Herstellung von Wirkstoffsalzen eine grosse Bedeutung. Starke Säuren können bei einer unsachgemässen Handhabung schwere Verätzungen der Haut, der Schleimhaut und der Augen verursachen. Die entsprechenden Vorsichtsmassnahmen im Sicherheitsdatenblatt müssen beachtet werden.
PharmaWikiSäuren sind, mit Ausnahme der Lewis-Säuren, chemische Verbindungen, die ein Proton (H+) auf eine Base übertragen können. Typische Vertreter sind zum Beispiel die Salzsäure, die Schwefelsäure, die Zitronensäure und die Essigsäure. Säuren haben ätzende, reizende und antimikrobielle Eigenschaften. Sie haben in der Pharmazie als Wirkstoffe, Hilfsstoffe und für die Herstellung von Wirkstoffsalzen eine grosse Bedeutung. Starke Säuren können bei einer unsachgemässen Handhabung schwere Verätzungen der Haut, der Schleimhaut und der Augen verursachen. Die entsprechenden Vorsichtsmassnahmen im Sicherheitsdatenblatt müssen beachtet werden.synonym: Acids, Acida, Azida, Acidum
ProdukteSäuren sind in zahlreichen Arzneimitteln als Wirkstoffe oder als Hilfsstoffe enthalten. Als Reinstoffe sind sie in Apotheken und Drogerien erhältlich. Im Haushalt findet man sie zum Beispiel im Zitronensaft, Fruchtsaft, im Essig und in Putzmitteln.
DefinitionSäuren (HA) sind, mit Ausnahme der Lewis-Säuren, chemische Verbindungen, die ein Proton (H+) an eine → Base abgeben können. Man nennt sie deshalb auch Protonendonatoren. Mit Wasser bilden sie das Hydronium-Ion H3O+:
- HA + H2O ⇄ H3O+ + A-
Reaktion mit einer Base (B):
- HA + B ⇄ HB+ + A-
Diese Reaktion ist durch eine Deprotonierung der Base reversibel. Weil sie in beide Richtungen verläuft, stellt sich ein Gleichgewicht ein.
H+ ist formal ein Wasserstoffatom ohne Elektron. Weil Wasserstoff nur aus einem Proton und einem Elektron besteht, bleibt bei der Abgabe des Elektrons nur das einzelne Proton übrig. Ein freies Proton kommt übrigens nicht vor, es ist immer eine Base vorhanden, die es aufnimmt.
Bei der Säure-Base-Reaktion entsteht aus der Säure die konjugierte Base und aus der Base die konjugierte Säure.
Mehrprotonige SäurenSäuren unterscheiden sich in der Anzahl der verfügbaren Protonen. Bei der Salzsäure (HCl) ist es nur ein Proton, bei der Phosphorsäure (H3PO4) sind es drei. Man spricht von mono-, di- und triprotonischen Säuren.
Dreistufige Deprotonierung der Phosphorsäure:
- H3PO4 → H2PO4- + H+ → HPO42- + H+ → PO43- + H+
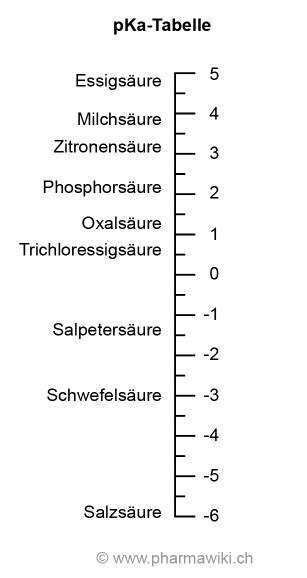
Des Weiteren unterscheiden sich Säuren in der Stärke, also in der Tendenz, das Proton abzugeben. So gehören etwa die Schwefelsäure, die Salpetersäure und die Salzsäure zu den starken, die Essigsäure hingegen zu den schwachen Säuren. Die starken Säuren dissoziieren vollständig zu Protonen und der konjugierten Base, die schwachen nur zu einem geringen Anteil.
Der pKa-Wert (oder pKs) ist das Mass für die Stärke der Säure. Je tiefer der Wert ist desto stärker ist die Säure. Der pKa ist von der Säuredissoziationskonstante (Säurenkonstante) Ka (Ks) abgeleitet. Es handelt sich um den negativen dekadischen Logarithmus.
- pKa = -log Ka
Es muss beachtet werden, dass es sich hierbei um eine logarithmische Skala handelt. Ein Unterschied von 1 auf dieser Skala entspricht 101, ein Unterschied von 5 demzufolge 105!
Zwischen Ethanol (pKa: 15.9) und der Essigsäure (pKa: 4.75) liegt also enormer Unterschied von 1011.
Eine grosse Bedeutung haben in der Pharmazie auch die entsprechenden Salze der Säuren, also beispielsweise Nitrate, Acetate, Sulfate, Carbonate oder Phosphate. Salze entstehen bei der Neutralisierung einer Säure mit einer Base:
- HCl (Salzsäure) + NaOH (Natriumhydroxid) → NaCl (Natriumchlorid) + H2O (Wasser)
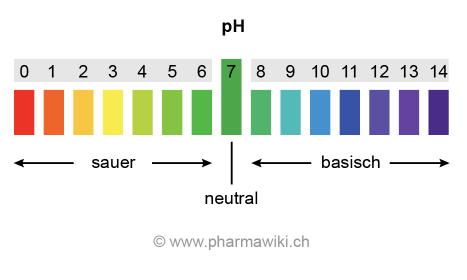
Wässrige Lösungen von Säuren haben einen pH-Wert unter 7. Der pH-Wert ist der negative dekadische Logarithmus der Hydronium-Ionen-Konzentration:
- pH = -log C(H3O+)
Die pH-Skala reicht von 0 (sauer) bis 14 (basisch). Auch hier bedeutet ein Unterschied von 1 den Wert 101.
pH-Skala, zum Vergrössern anklicken. Illustration © PharmaWiki
WirkungenSäuren haben ätzende, reizende, antiseptische und antimikrobielle Eigenschaften. Sie haben einen sauren Geschmack und können viele Materialien angreifen, zum Beispiel unedle Metalle und Kalkstein.
AnwendungsgebieteZu den pharmazeutischen und medizinischen Anwendungsgebieten gehören:
- Als Ätzmittel gegen Warzen und Hühneraugen.
- Für die Herstellung von Wirkstoffsalzen.
- Für die Vorbeugung und Behandlung von Infektionskrankheiten, als Desinfektionsmittel.
- Säuren werden in ausreichender Verdünnung bei verminderter Magensäureproduktion zur Verbesserung der Verdauung eingesetzt.
- Die Anhebung des pH-Werts im Magen, z.B. durch Protonenpumpen-Inhibitoren, kann die Bioverfügbarkeit anderer Medikamente verringern. Zur temporären Ansäuerung des Magens können Säuren, z.B. in Form eines Colagetränks, eingenommen werden.
- Als pharmazeutische Hilfsstoffe, zum Beispiel als Konservierungsmittel, in Brausetabletten und zur Einstellung des pH-Werts. Für die Herstellung von Pufferlösungen.
- Als Reinigungsmittel.
- Für chemische Synthesen, als Reagenzien.
- Als Katalysatoren für chemische Reaktionen.
- Als Lebensmittelzusatzstoffe.
Anorganische Säuren, Mineralsäuren:
Organische Säuren:
- Äpfelsäure
- Ameisensäure
- Ascorbinsäure
- Benzoesäure
- Chloressigsäure
- Essigsäure
- Fettsäuren
- Milchsäure
- Nukleinsäuren
- Oxalsäure
- Pikrinsäure
- Salicylsäure
- Trichloressigsäure
- Weinsäure
- Zitronensäure
Viele pharmazeutische Wirkstoffe sind Säuren.
Säure-Base-ReaktionenSiehe im Artikel Säure-Base-Reaktionen.
Unerwünschte WirkungenSäuren haben ätzende und reizende Eigenschaften und können zu Verätzungen der Haut, der Schleimhaut und der Augen führen. Die Einnahme starker Säuren kann lebensgefährlich sein. Die entsprechenden Vorsichtsmassnahmen im Sicherheitsdatenblatt müssen beachtet werden (z.B. Schutzhandschuhe, Abzug, Schutzbrille, Labormantel, Atemschutz).
siehe auchBasen, Salze, Wasserstoff, Carbonsäuren, Säure-Base-Reaktionen
Literatur- Arzneimittel-Fachinformation (CH)
- Europäisches Arzneibuch PhEur
- Fachliteratur
- Lehrbücher der Chemie
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.