Chemische Elemente
 MaterieUnsere gesamte Welt, alle Lebewesen und wir selbst bestehen aus chemischen Elementen, die aus den Protonen, Neutronen und Elektronen aufgebaut sind. Welche Elemente gibt es? Wie sind sie entstanden? Welche Eigenschaften haben sie? Dieser Artikel gibt eine kurze Einführung in dieses faszinierende Thema.Aufbau der Materie
MaterieUnsere gesamte Welt, alle Lebewesen und wir selbst bestehen aus chemischen Elementen, die aus den Protonen, Neutronen und Elektronen aufgebaut sind. Welche Elemente gibt es? Wie sind sie entstanden? Welche Eigenschaften haben sie? Dieser Artikel gibt eine kurze Einführung in dieses faszinierende Thema.Aufbau der MaterieUnsere Erde, die Natur, alle Lebewesen, Gegenstände, die Kontinente, Gebirge, Meere und wir selbst bestehen aus chemischen Elementen, die auf unterschiedliche Art und Weise miteinander verbunden sind. Das Leben ist durch die Verbindung der Elemente entstanden.
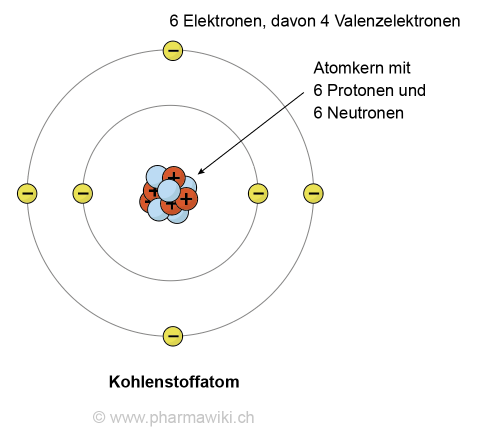
Chemische Elemente sind Atome mit derselben Anzahl Protonen im Atomkern. Die Anzahl wird als sogenannte Ordnungszahl Z (im Englischen atomic number, Atomnummer) bezeichnet. So hat beispielsweise Kohlenstoff die Ordnungszahl 6 und hat folglich 6 Protonen im Kern.
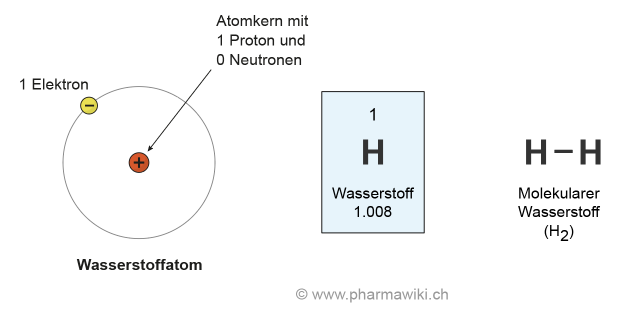
Das einfachste Element ist Wasserstoff (H) mit einem Proton und einem Elektron (Ordnungszahl 1, ohne Neutronen). Auch Reinstoffe werden als Elemente bezeichnet, also zum Beispiel reiner Sauerstoff. Sie lassen sich mit einfachen chemischen und physikalischen Methoden nicht weiter teilen. Elemente können fest, gasförmig oder seltener flüssig vorliegen (Aggregatzustände). 94 Elemente kommen natürlich vor und viele weitere wurden künstlich hergestellt. Das Element mit der höchsten Ordnungszahl, das auf der Erde natürlich vorkommt, ist das radioaktive Plutonium (Ordnungszahl 94).
Wasserstoff, zum Vergrössern anklicken. Illustration © PharmaWiki
Zusammensetzung der ElementeDie einzelnen chemischen Elemente sind aus positiv geladenen Protonen, neutralen Neutronen und negativ geladenen Elektronen zusammengesetzt. Der Atomkern besteht aus Protonen und Neutronen die gemeinsam als Nukleonen bezeichnet werden, die Elektronen befinden sich der Atomhülle (Elektronenhülle).
- Nukleonen = Protonen + Neutronen
Die Anzahl der Protonen und Elektronen entsprechen sich bei ungeladenen Atomen. Weil sich die Ladungen ausgleichen, sind die Elemente gegen aussen elektrisch neutral. Geben sie jedoch ein Elektron ab, werden sie positiv geladen (Kationen). Nehmen sie eines auf, sind sie negativ geladen (Anionen). Geladene Atome werden als Ionen bezeichnet. Zusammen bilden sie neutrale Salze.
Kohlenstoff, zum Vergrössern anklicken. Illustration © PharmaWiki
Atome werden – auch in diesem Text – häufig mit dem veralteten Bohrschen Atommodell dargestellt, bei dem die Elektronen den Atomkern auf definierten Bahnen umkreisen, also wie die Planeten die Sonne. Heute wird für die Darstellung der Elektronen in der Regel das quantenmechanische Orbitalmodell verwendet, bei welchen die Elektronen im Raum um den Kern eine bestimmte Aufenthaltswahrscheinlichkeit haben.
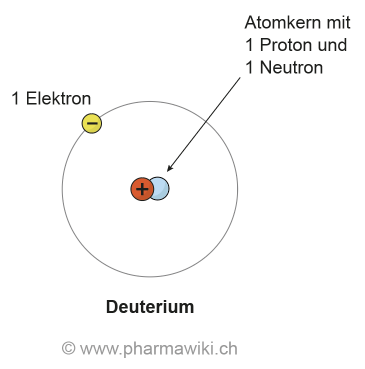
IsotopeIsotope sind Atome, die sich nur in der Anzahl der Neutronen und deshalb auch in der Masse unterscheiden. Dies bei derselben Anzahl Protonen. So ist beispielsweise Deuterium (2H) ein Isotop von Wasserstoff (1H) mit einem Neutron. Weil die Masse grösser ist, wird Deuterium (D) als schwerer Wasserstoff bezeichnet und Deuteriumoxid als schweres Wasser (D2O). Zu den bekanntesten Isotopen gehören die Uran-Isotope, deren Atomkerne spaltbar sind (Uran-235) und die in Kernkraftwerken und für die Herstellung von Atomwaffen und -antrieben verwendet werden.
Deuterium, zum Vergrössern anklicken. Illustration © PharmaWiki
Herkunft der ElementeDie einfachsten Elemente Wasserstoff (Z = 1) und Helium (Z = 2) sind vor 13.8 Milliarden Jahren während des Urknalls kurz nach der Entstehung unseres Universums entstanden. Wasserstoff ist im heute weit ausgedehnten Universum nach wie vor das häufigste Element, gefolgt von Helium.
Die meisten übrigen Elemente sind entweder in Sternen durch eine Kernfusion oder bei einer Supernova, in sterbenden Sternen, entstanden. Einige wenige sind durch den Einfluss kosmischer Strahlung hervorgegangen (Lithium, Beryllium, Bor). Schliesslich existieren Elemente mit einer hohen Ordnungszahl, die künstlich, von Menschen hergestellt wurden.
BeispieleDie folgende Liste zeigt eine Auswahl von Elementen. In den Klammern ist das chemische Symbol (Elementsymbol) dargestellt, also beispielsweise C (Carbon, von lat. carbo, Kohle) für Kohlenstoff. Die Abkürzung hat entweder einen oder zwei Buchstaben.
- Wasserstoff (H) ist neben Sauerstoff ein Bestandteil von Wasser.
- Kohlenstoff (C) ist der Grundbaustein für alles Leben auf der Erde.
- Stickstoff (N) ist der quantitativ wichtigste Bestandteil der Luft.
- Sauerstoff (O) ist für die Energiegewinnung im Körper essenziell.
- Natrium (Na) ist im Kochsalz enthalten.
- Magnesium (Mg) kommt im Chlorophyll (Blattgrün) vor.
- Aluminium (Al) ist in Aluminiumfolien und Autokarosserien enthalten.
- Silicium (Si) kommt in fast allen Mineralien und Gesteinen der Erde vor.
- Phosphor (P) wird für die Herstellung von Streichhölzern verwendet.
- Schwefel (S) wird von Vulkanen freigesetzt.
- Kalium (K) spielt für die Funktion der Nerven eine zentrale Rolle.
- Calcium (Ca) ist in Knochen enthalten.
- Eisen (Fe) ist das häufigste Element des Planeten Erde.
- Quecksilber (Hg) liegt im Unterschied zu anderen Metallen als Flüssigkeit vor.
- Blei (Pb) wurde im römischen Reich vielseitig verwendet, zum Beispiel für Wasserleitungen.
- Nickel (Ni) wird für Metalllegierungen verwendet.
- Silber (Ag) und Gold (Au) sind im Schmuck enthalten.
- Uran (U) und Plutonium (Pu) werden für Kernwaffen und Kernkraftwerke verwendet.
Fast die gesamte Masse eines Atoms liegt im Kern. Das Volumen wird hingegen von der Elektronenhülle bestimmt, weil der Kern so klein ist.
Die Masse der Atome wird mit dem Symbol u oder Da (Daltons) angegeben. u steht für unified atomic mass. Sie entspricht der Masse der Protonen, Neutronen und Elektronen. 1 u ist als Zwölftel der Masse von Kohlenstoff-12 (12C) definiert und beträgt 1.660 · 10-24 g.
Die Masse eines Protons und eines Neutrons beträgt etwa 1 u, also eine Masseinheit. Weil Kohlenstoff-12 6 Protonen und 6 Neutronen enthält und die Elektronen eine sehr geringe Masse haben (1/1836 eines Protons), ist seine Atommasse etwa 12 u (12.011 u). Diese Zahl wird als Massenzahl A bezeichnet.
Massenzahl A = Anzahl Protonen Z + Anzahl Neutronen N

Die Molekülmasse von chemischen Verbindungen lässt sich durch Addition der Atommassen der Atome erhalten, aus welchen sie bestehen.
Atome sind unvorstellbar klein – ihr Durchmesser liegt im Bereich von 10-10 m (1 Ångström, 0.1 nm).
Chemische VerbindungenChemische Elemente verbinden sich sehr gerne mit gleichen oder anderen Elementen ‐ rein oder ungebunden kommen sie nur selten vor. Für die chemischen Verbindungen sind ausschliesslich die Elektronen in der Atomhülle verantwortlich, die Atomkerne sind nicht beteiligt.
Die wichtigsten chemischen Verbindungen sind:
- Organische Moleküle mit kovalenten Bindungen (Moleküle)
- Salze mit ionischen Bindungen (ionische Verbindungen)
- Metalle mit der metallischen Bindung
- Komplexe (Komplexbildung)
Das Besondere an den chemischen Verbindungen ist, dass ihre Eigenschaften vollkommen anders sind als diejenigen der Elemente, aus welchen sie bestehen. So ist beispielsweise Natriumchlorid aus ionisierten Natrium- und Chloratomen aufgebaut. Natrium als Element ist ein weiches, silbergraues Metall, das hoch reaktiv ist und Chlor liegt (bei Raumtemperatur) als giftiges Gas vor. Zusammen bilden sie das kristalline Kochsalz, das wir täglich als Geschmacksverstärker in Lebensmitteln zu uns nehmen. Dasselbe lässt sich am Beispiel Wasser veranschaulichen, das aus den Gasen Wasserstoff und Sauerstoff bei der Knallgasreaktion entsteht.
PeriodensystemDas Periodensystem der Elemente ist eine anschauliche und praktische Übersicht aller Elemente, die erstmals in den 1860er-Jahren entwickelt wurde. Es beginnt mit Wasserstoff (1) und ist nach steigender Atomnummer geordnet. Durch die Darstellung in horizontale Perioden und senkrechte Gruppen werden verwandte Elemente mit ähnlichen chemischen und physikalischen Eigenschaften zusammengefasst. Dazu gehören:
- Alkalimetalle
- Erdalkalimetalle
- Übergangsmetalle
- Lanthanoide
- Actinoide
- Metalle
- Halbmetalle
- Nichtmetalle
- Halogene
- Edelgase
Elemente können aus Mischungen gewonnen werden, die verschiedenen chemischen und physikalischen Trennverfahren unterworfen werden, also beispielsweise einer Verbrennung, einem elektrischen Strom oder einer Versetzung mit Säuren. Am Ende bleiben bei den gängigen Verfahren die reinen Elemente zurück.
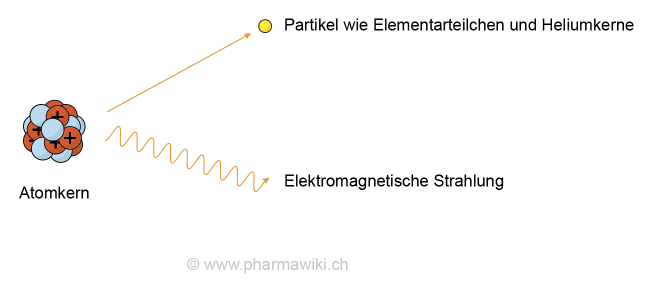
Der Begriff Atom leitet sich vom griechischen átomos ab, was unteilbar bedeutet. Tatsächlich sind die Elemente mit den üblichen chemischen Methoden nicht weiter teilbar. Mit der Entdeckung der Radioaktivität und des radioaktiven Zerfalls hat sich jedoch gezeigt, dass der Begriff unzutreffend ist und eine sogenannte Kernspaltung in Elemente mit einer tieferen Ordnungszahl möglich ist. Umgekehrt können bei einer Kernfusion Elemente mit einer höheren Ordnungszahl hergestellt werden. So bildet beispielsweise die Sonne in ihrem Kern Helium aus Wasserstoff, was die Energie und Wärme freisetzt, welche die Grundlage allen Lebens auf der Erde darstellt.
Radioaktivität, zum Vergrössern anklicken. Illustration © PharmaWiki
Aufbau des MenschenWie bereits eingangs erwähnt, sind auch wir Menschen aus den bekannten Elementen aufgebaut. Die wichtigsten Vertreter sind Sauerstoff (O), Kohlenstoff (C), Wasserstoff (H), Stickstoff (N), Calcium (Ca) und Phosphor (P). Diese 6 Elemente machen zusammen über 99 % der Körpermasse aus!
Weitere Mineralstoffe wie beispielsweise Kalium, Magnesium und Natrium sowie zahlreiche Spurenelemente wie etwa Chrom, Eisen, Fluor, Selen oder Kupfer sind zwar in einer weitaus geringeren Menge enthalten, haben aber lebensnotwendige Funktionen.
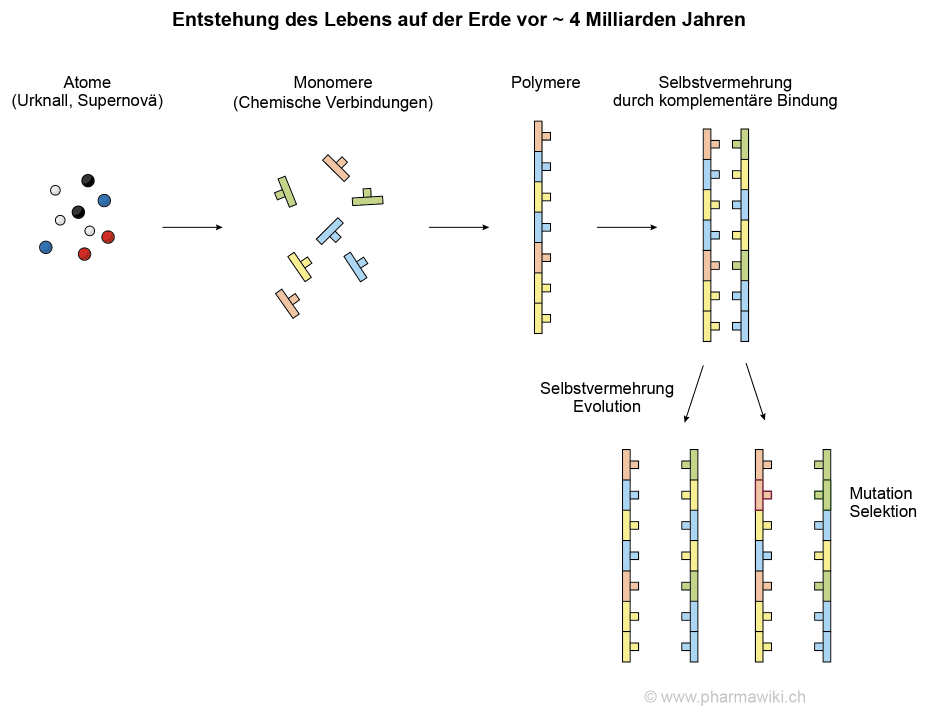
Ursprung des Lebens auf der ErdeDie Elemente auf der Erde stammen, wie bereits erwähnt, einerseits vom Urknall, der vor etwa 13.8 Milliarden Jahren stattgefunden hat und mit dem das Universum, der Raum und die Zeit entstanden ist. Höhere Elemente wurden hauptsächlich in aktiven und sterbenden Sternen (Supernovae) gebildet. Die Erde hat ein Alter von etwa 4.5 Milliarden Jahren. Das Leben auf der Erde ist vor vielleicht 4 Milliarden Jahren aus der unbelebten Natur spontan durch die Verbindung der Elemente zu organischen chemischen Verbindungen hervorgegangen, siehe im Artikel Selbstvermehrende Moleküle. Die Elemente dafür stammten aus der Luft, den Gesteinen und dem Wasser (Atomosphäre, Lithosphäre, Hydrosphäre).
Selbstvermehrende Moleküle. Der Prozess ist stark vereinfacht. Zum Vergrössern anklicken. Illustration © PharmaWiki
siehe auchVerbindungen, Moleküle, Salze, Valenzelektronen, Chemische Reaktionen, Polymere, Materie, Zellen, Emergenz, Selbstvermehrende Moleküle
Literatur- Fachliteratur
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.