Sauerstoff
 Arzneimittelgruppen
Arzneimittelgruppen  Chemische Elemente
Chemische Elemente  Medizinische GaseSauerstoff ist ein chemisches Element und ein medizinisches Gas, das für die Vorbeugung und Behandlung von hypoxischen und hypoxämischen Zuständen verabreicht wird, zum Beispiel bei Atemstörungen, Herz-Kreislauf-Erkrankungen oder Schockzuständen. Sauerstoff ist ein lebenswichtiger Bestandteil der Atemluft, der im Körper unter anderem für die Energiegewinnung benötigt wird. Als Arzneimittel wird Sauerstoff inhalativ verabreicht. Zu hohe Sauerstoffkonzentrationen sind für den Menschen giftig und Sauerstoff hat als Oxidationsmittel brandfördernde Eigenschaften.
Medizinische GaseSauerstoff ist ein chemisches Element und ein medizinisches Gas, das für die Vorbeugung und Behandlung von hypoxischen und hypoxämischen Zuständen verabreicht wird, zum Beispiel bei Atemstörungen, Herz-Kreislauf-Erkrankungen oder Schockzuständen. Sauerstoff ist ein lebenswichtiger Bestandteil der Atemluft, der im Körper unter anderem für die Energiegewinnung benötigt wird. Als Arzneimittel wird Sauerstoff inhalativ verabreicht. Zu hohe Sauerstoffkonzentrationen sind für den Menschen giftig und Sauerstoff hat als Oxidationsmittel brandfördernde Eigenschaften.synonym: Oxygenium PhEur, Oxygenium medicinale, Medizinalsauerstoff, Dioxygen, O, O2, O3
ProdukteSauerstoff ist in Form von Druckgasflaschen (Sauerstoffflaschen) mit einer weissen Farbe als komprimiertes Gas im Handel.
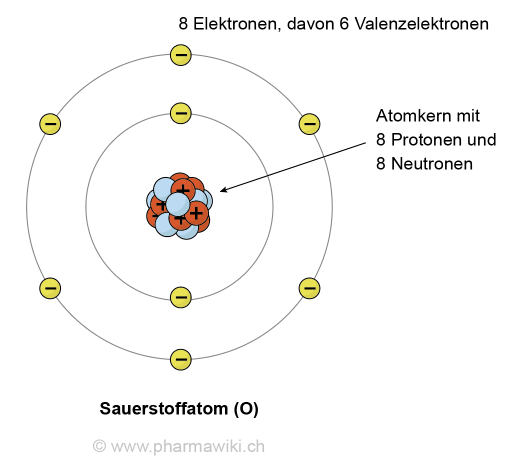
Sauerstoffatom, zum Vergrössern anklicken. Illustration © PharmaWiki
Struktur und EigenschaftenSauerstoff (Symbol: O, elementar: O2, Ordnungszahl: 8, Atommasse: 15.999) liegt als Dioxygen (O2, O=O) als farbloses, geschmackloses und geruchloses Gas vor, das in Wasser wenig löslich ist. Diese Wasserlöslichkeit ist wichtig für die im Wasser lebenden Tieren wie die Fische. Sauerstoff gehört zu den Nichtmetallen.
Flüssiger Sauerstoff hat eine hellblaue Farbe. Der Siedepunkt, also die Temperatur des Übergangs von flüssigem zu gasförmigem Sauerstoff, liegt bei -183 °C.
Sauerstoff ist das bekannteste Oxidationsmittel. Er nimmt in der Regel zwei Elektronen auf und wird dabei reduziert. Der Grund ist seine hohe Elektronegativität. Er bildet mit vielen anderen Elementen Oxide oder Dioxide. So geben beispielsweise Metalle Elektronen ab, die vom Sauerstoff aufgenommen werden. Bei der Bildung von Magnesiumoxid werden zwei Elektronen vom elementaren Magnesium auf den Sauerstoff übertragen:
- 2 Mg: (Magnesium elementar) + O2 (Sauerstoff) → 2 MgO (Magnesiumoxid)
Siehe auch im Artikel Redox-Reaktionen.
Metalloxide (Beispiele):
Metalloxide sind Festkörper, die mit Wasser basisch reagieren. Mit Nichtmetallen können feste, flüssige oder gasförmige Oxide gebildet werden. Oxidation von Nichtmetallen:
- Kohlenstoff: Kohlenstoffmonoxid, Kohlenstoffdioxid (Verbrennung)
- Schwefel: Schwefeldioxid
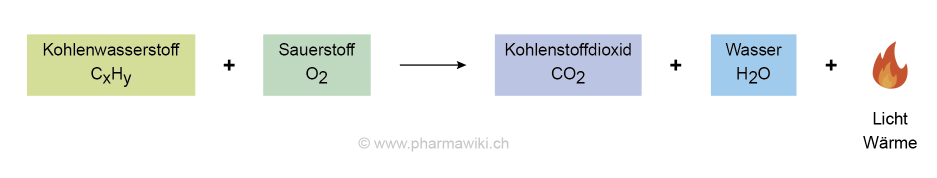
Die Verbrennung von organischen Verbindungen ist für die Energiegewinnung wichtig, zum Beispiel mit Methangas, dem Bestandteil des Erdgases:
- CH4 (Methan) + 2 O2 (Sauerstoff) → CO2 (Kohlenstoffdioxid) + 2 H2O (Wasser)
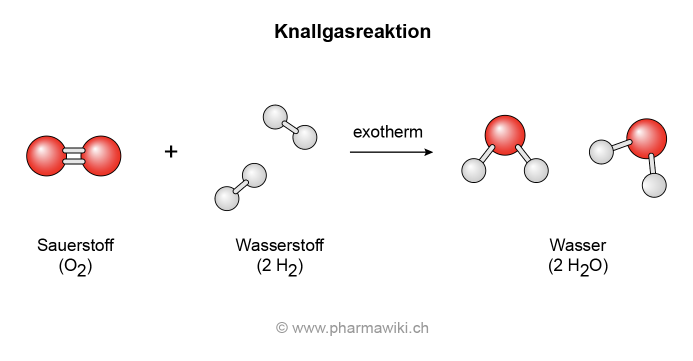
Bekannt die auch die explosive Reaktion mit Wasserstoff, die Knallgasreaktion:
- 2 H2 (Wasserstoff) + O2 (Sauerstoff) → 2 H2O (Wasser = Dihydrogenmonoxid)
Die meisten Oxidationen mit Sauerstoff sind exotherm, d.h. es wird Energie, Licht und Wärme freigesetzt. Umgekehrt kann Sauerstoff auch mithilfe einer Elektrolyse aus Wasser gewonnen werden.
Sauerstoff ist wie bereits erwähnt in Druckgasflaschen erhältlich. Im Labor kann er auch aus Oxidationsmitteln wie Kaliumchlorat oder Natriumchlorat durch Erwärmung gewonnen werden, da diese bei der Erwärmung Sauerstoff abgeben.
Pflanzen bilden Sauerstoff als „Abfallprodukt“ bei der Photosynthese unter dem Einfluss von Licht:
- 6 CO2 (Kohlenstoffdioxid) + 6 H2O (Wasser) → C6H12O6 (Glucose) + O2 (Sauerstoff)
Im Menschen verläuft diese Reaktion in die entgegengesetzte Richtung, wobei Energie freigesetzt wird.
Knallgasreaktion mit Sauerstoff und Wasserstoff, zum Vergrössern anklicken. Illustration © PharmaWiki
WirkungenSauerstoff (ATC V03AN01  ) ist für das Leben unverzichtbar. Nicht nur deshalb, weil er in den Mitochondrien als Oxidationsmittel für die Synthese des Energieträgers Adenosintriphosphat essenziell ist. Sondern auch, weil Sauerstoff zu den 6 chemischen Elementen gehört, welche über 99 % der Körpermasse ausmachen. Der Anteil von Sauerstoff beträgt etwa 60 %.
) ist für das Leben unverzichtbar. Nicht nur deshalb, weil er in den Mitochondrien als Oxidationsmittel für die Synthese des Energieträgers Adenosintriphosphat essenziell ist. Sondern auch, weil Sauerstoff zu den 6 chemischen Elementen gehört, welche über 99 % der Körpermasse ausmachen. Der Anteil von Sauerstoff beträgt etwa 60 %.
Er ist in fast allen wichtigen Biomolekülen enthalten, zum Beispiel in Aminosäuren, Proteinen, Kohlenhydraten, Nukleinsäuren, Lipiden und Vitaminen. Dies hängt auch damit zusammen, dass er in vielen funktionellen Gruppen vorkommt, zum Beispiel in Alkohlen, Aldehyden, Carbonsäuren, Ethern, Estern und Ketonen. Auch in vielen anorganischen Salzen ist er enthalten – und natürlich im Wasser.
Luft ist ein Gasgemisch, das nur zu etwa 21 % aus Sauerstoff besteht. Und Sauerstoff ist auch in den meisten Mineralien und Gesteinen enthalten, zum Beispiel als Siliciumdioxid im Quarz oder als Calciumcarbonat im Kalkstein. Silicium hat eine hohe Affinität zu Sauerstoff.
Im Körper diffundiert Sauerstoff aus der Lunge in den Blutkreislauf, wo er vom Hämoglobin in den roten Blutkörperchen aufgenommen und zum peripheren Gewebe transportiert wird.
Indikationen- Sauerstoff wird in der Medizin hauptsächlich für die Vorbeugung und Behandlung von hypoxischen und hypoxämischen Zuständen verabreicht, zum Beispiel bei Atemstörungen, Herz-Kreislauf-Erkrankungen oder Schockzuständen. Auch in der Anästhesie spielt er eine wichtige Rolle.
- In der Pharmazie ist Sauerstoff in zahlreichen Wirkstoffen und Hilfsstoffen enthalten.
- Für die Akutbehandlung von Cluster-Kopfschmerzen.
- Als Desinfektionsmittel, z.B. in Form von Wasserstoffperoxid (Freisetzung von Sauerstoff).
- Für Radiopharmaka (Isotope).
Zerfall von Wasserstoffperoxid:
- 2 H2O2 (Wasserstoffperoxid) → 2 H2O (Wasser) + O2 (Sauerstoff)
Der Zerfall kann durch die Zugabe eines Katalysators wie Mangandioxid (MnO2) beschleunigt werden.
DosierungGemäss der Fachinformation. Sauerstoff wird inhalativ verarbeicht. Während der Behandlung soll der arterielle Sauerstoffdruck (PaO2) oder die arterielle Sauerstoffsättigung (Pulsoxymetrie) überwacht werden.
MissbrauchOxidierende Stoffe wie Kaliumnitrat, Ammoniumnitrat und Kaliumchlorat können für die illegale Herstellung von Sprengstoffen missbraucht werden. Sie liefern den Sauerstoff, der für die explosive Reaktion zu Gasen benötigt wird.
KontraindikationenDie vollständigen Vorsichtsmassnahmen finden sich in der Arzneimittel-Fachinformation.
Unerwünschte WirkungenZu hohe Sauerstoffkonzentrationen sind für den Menschen giftig, zelltoxisch und lebensbedrohlich. Sauerstoff hat als Oxidationsmittel brandfördernde Eigenschaften. Es kann Brände auslösen oder verstärken, weil Oxidationen bei einer höheren Konzentration effizienter ablaufen. Dies kann mit einem glühenden Holzspan veranschaulicht werden, der unter starker Sauerstoffeinwirkung zu brennen beginnt. Sauerstoffflaschen mit dem komprimierten Gas können bei einer Erwärmung explodieren.
Verbrennung eines Kohlenwasserstoffs, zum Vergrössern anklicken. Illustration © PharmaWiki
siehe auchChemische Elemente, Wasserstoff, Redox-Reaktionen, Medizinische Gase, Luft, Ozon
Literatur- Arzneimittel-Fachinformation (CH, D)
- Europäisches Arzneibuch PhEur
- Fachliteratur
- Lehrbücher der Chemie
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
Weitere Informationen