Helium
 Arzneimittelgruppen
Arzneimittelgruppen  Gase
Gase  Medizinische GaseHelium (He) ist ein chemisches Element, das aus zwei Protonen, zwei Neutronen und zwei Elektronen besteht. Es liegt als geruchloses, geschmackloses und farbloses Gas mit einem sehr tiefen Siedepunkt nahe beim absoluten Nullpunkt vor. Weil seine einzige Elektronenschale mit zwei Elektronen besetzt ist, ist Helium sehr reaktionsträge und geht chemische Reaktionen nur unter extremen Bedingungen ein. Es kommt daher atomar vor. Gewonnen wird Helium aus Erdgas, in dem es natürlich enthalten ist. Helium wird unter anderem mit Sauerstoff als Atemgas, als Kühlmittel, als Traggas für Ballone und Luftschiffe und in der Lebensmittelindustrie verwendet. Helium ist atoxisch und ungefährlich. Allerdings kann es aufgrund der Verdrängung des Sauerstoffs in der Luft zu einer Erstickung führen und flüssiges Helium ist kalt und kann eine Erfrierung hervorrufen. Produkte
Medizinische GaseHelium (He) ist ein chemisches Element, das aus zwei Protonen, zwei Neutronen und zwei Elektronen besteht. Es liegt als geruchloses, geschmackloses und farbloses Gas mit einem sehr tiefen Siedepunkt nahe beim absoluten Nullpunkt vor. Weil seine einzige Elektronenschale mit zwei Elektronen besetzt ist, ist Helium sehr reaktionsträge und geht chemische Reaktionen nur unter extremen Bedingungen ein. Es kommt daher atomar vor. Gewonnen wird Helium aus Erdgas, in dem es natürlich enthalten ist. Helium wird unter anderem mit Sauerstoff als Atemgas, als Kühlmittel, als Traggas für Ballone und Luftschiffe und in der Lebensmittelindustrie verwendet. Helium ist atoxisch und ungefährlich. Allerdings kann es aufgrund der Verdrängung des Sauerstoffs in der Luft zu einer Erstickung führen und flüssiges Helium ist kalt und kann eine Erfrierung hervorrufen. ProdukteHelium ist in Druckgasflaschen erhältlich.
Struktur und EigenschaftenHelium (He, Ordnungszahl: 2, Atommasse: 4.00 u) ist ein farbloses, geruchloses, geschmackloses und atoxisches Gas und der erste Vertreter der Edelgase. Es ist nach Wasserstoff (H) das zweite Element im Periodensystem. Helium besteht aus zwei Protonen, zwei Neutronen und zwei Elektronen. Es existieren verschiedene Isotope mit einer unterschiedlichen Anzahl Neutronen. Aufgrund seiner fehlenden Reaktivität liegt es nur atomar vor (He). Helium bildet keine Dimere wie zum Beispiel Wasserstoff (H2) oder Sauerstoff (O2).
Sein Siedepunkt liegt bei -268.9 °C, also sehr nahe beim absoluten Nullpunkt von -273.15 °C. Unter Normaldruck bildet sich auch beim weiteren Abkühlen kein Festkörper.
Helium ist nach Wasserstoff das häufigste chemische Element im Universum. Das meiste ist innert Minuten nach dem Urknall entstanden.
Helium wurde im 19. Jahrhundert im Sonnenlicht entdeckt und wurde deshalb nach der Sonne benannte (altgriechisch: helios). Die Sonne besteht fast zu einem Viertel aus Helium, weil es bei der Kernfusion aus Wasserstoff entsteht. Dieser Prozess liefert die meiste Energie, welche auf der Erde zur Verfügung steht.
Helium ist auch ein natürlicher Bestandteil der Luft, allerdings in einer sehr geringen Konzentration (5 ppm). Es entsteht zum Beispiel beim radioaktiven Zerfall von Uran und es kommt im Erdgas vor, aus welchem es vorwiegend gewonnen wird. Die radioaktive Alphastrahlung besteht aus Heliumkernen.
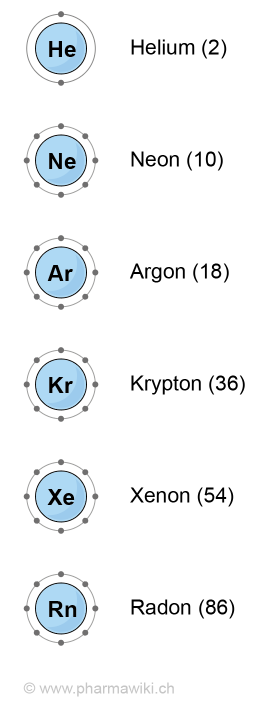
Die sechs natürlichen Edelgase mit den äussersten zwei oder acht Valenzelektronen, zum Vergrössern anklicken. Illustration © PharmaWiki
WirkungenHelium ist chemisch inert und sehr reaktionsträge. Es sind keine stabilen Verbindungen mit Helium bekannt. Dies abgesehen von solchen, welche bei extremen Bedingungen gebildet werden, zum Beispiel bei tiefsten Temperaturen und unter hohem Druck. Der Grund liegt darin, dass die einzige Elektronenschale mit zwei Elektronen voll besetzt ist („Edelgaskonfiguration“).
Aufgrund seiner geringen Dichte kann Helium für die Luftfahrt verwendet werden. Es eignet sich besser als Wasserstoff, weil es nicht brennbar und nicht explosiv ist.
Anwendungsgebiete- In der Medizin zusammen mit Sauerstoff als Atemgas (Heliox).
- Für die Gaschromatographie.
- Helium wird häufig als Kühlmittel verwendet, insbesondere für sehr tiefe Temperaturen.
- Als Traggas für Ballone und Luftschiffe.
- Für Experimente zur Veränderung der Stimme. Der Grund dafür liegt in der schnelleren Schallgeschwindigkeit in Helium.
- Viele technische Anwendungsgebiete, zum Beispiel beim Schweissen.
- In der Lebensmittelindustrie (E 939).
Helium ist atoxisch. Bei der Inhalation von Helium besteht die Gefahr einer Erstickung, weil der Sauerstoff in der Luft durch das Helium verdrängt wird. Das Gas darf deshalb nicht übermässig und lange inhaliert werden!
Flüssiges Helium ist sehr kalt und kann Erfrierungen verursachen. Und schliesslich können Druckgasflaschen bei einer Erwärmung explodieren.
siehe auchLiteratur- Arzneimittel-Fachinformation (CH)
- Fachliteratur
- Lehrbücher der Chemie
- Produkteinformationen
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.