Alkalimetalle
 Chemische Elemente
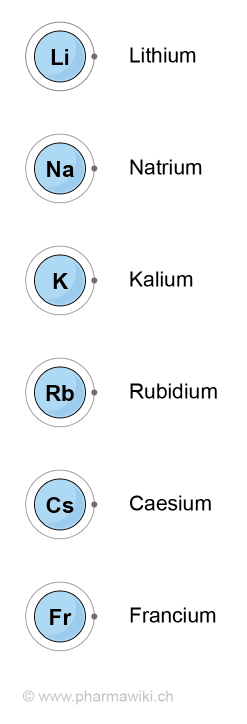
Chemische Elemente  MetalleAlkalimetalle sind eine Gruppe chemischer Elemente der ersten Hauptgruppe des Periodensystems. Sie liegen elementar als Leichtmetalle mit einer vergleichsweise geringen Dichte und einem tiefen Schmelzpunkt vor. Zu dieser Gruppe gehören Lithium, Natrium, Kalium, Rubidium, Caesium und das radioaktive Francium. Alkalimetalle haben ein Valenzelektron, das sie als Reduktionsmittel abgeben und sind sehr reaktiv. In der Natur kommen sie nicht metallisch vor. Als Ionen sind sie für den menschlichen Körper von essenzieller Bedeutung, zum Beispiel für das Membran- und Aktionspotenzial.
MetalleAlkalimetalle sind eine Gruppe chemischer Elemente der ersten Hauptgruppe des Periodensystems. Sie liegen elementar als Leichtmetalle mit einer vergleichsweise geringen Dichte und einem tiefen Schmelzpunkt vor. Zu dieser Gruppe gehören Lithium, Natrium, Kalium, Rubidium, Caesium und das radioaktive Francium. Alkalimetalle haben ein Valenzelektron, das sie als Reduktionsmittel abgeben und sind sehr reaktiv. In der Natur kommen sie nicht metallisch vor. Als Ionen sind sie für den menschlichen Körper von essenzieller Bedeutung, zum Beispiel für das Membran- und Aktionspotenzial.synonym: Alkali metals
ProdukteAlkalimetalle sind für Fachpersonen im Fachhandel erhältlich. Aufgrund ihrer hohen Reaktivität werden sie in Paraffinen (Mineralöl) gelagert.
Struktur und EigenschaftenAlkalimetalle sind chemische Elemente, welche zur ersten Hauptgruppe des Periodensystems gehören:
Alkalimetalle liegen als glänzende und weiche Leichtmetalle vor. Sie haben ein Valenzelektron, das sie als Reduktionsmittel mit einer tiefen Elektronegativität sehr gerne abgeben und sie sind sehr reaktiv. In der Natur kommen sie deshalb nicht elementar vor. Alkalimetalle können mithilfe einer Elektrolyse in den metallischen Zustand überführt werden.
Im Unterschied zu anderen Metallen können Alkalimetalle mit einem Messer geschnitten werden, haben eine geringere Dichte und einen vergleichsweise tiefen Schmelzpunkt.
Wasserstoff steht im Periodensystem oberhalb der Alkalimetalle in der ersten Hauptgruppe. Es wird nicht zu ihnen gezählt, weil es sich um ein Gas und Nichtmetall handelt und es gänzlich andere Eigenschaften hat.
Typisch für diese Gruppe ist die Färbung einer Flamme durch die Metalle und ihre Salze. So färbt beispielsweise Natrium die Flamme gelb und Kalium violett.
Äusserste Valenzelektronen der Alkalimetalle, zum Vergrössern anklicken. Illustration © PharmaWiki
ReaktionenAlkalimetalle sind Reduktionsmittel und nehmen als solche an Redox-Reaktionen mit Oxidationsmitteln teil.
Sie geben ein Elektron ab und reagieren mit allen Nichtmetallen. Am Beispiel Natrium:
- Na (Natrium, elementar) → Na+ (Natrium, Kation) + e- (Elektron)
Alkalimetalle bilden Oxide mit Sauerstoff:
- 4 Na (Natrium) + O2 (Sauerstoff) → 2 Na2O
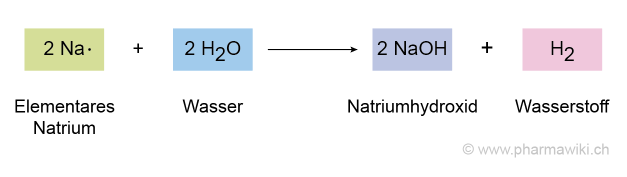
Alkalimetalle reagieren stark exotherm und teilweise explosiv mit Wasser und bilden dabei Hydroxide und Wasserstoff:
- 2 Na (Natrium) + 2 H2O (Wasser) → 2 NaOH (Natriumhydroxid) + H2 (Wasserstoff)
Alkalimetalle reagieren mit Wasserstoff zu Hydriden:
- 2 Na (Natrium) + H2 (Wasserstoff) → 2 NaH (Natriumhydrid)
Die heftige Reaktion von Natrium mit Wasser, zum Vergrössern anklicken. Illustration © PharmaWiki
Anwendungsgebiete- Für chemische Reaktionen und Synthesen. Die Salze sind wichtige Chemikalien, z.B. Natriumhydroxid oder Natriumcarbonat.
- In der Pharmazie haben die Salze der Alkalimetalle eine grosse Bedeutung als Wirkstoffe und Hilfsstoffe. Beispiele sind Lithium für die Behandlung einer bipolaren Störung sowie Kalium für die Therapie eines Kaliummangels.
- Für Radiopharmaka (Isotope).
- Für die Herstellung von Batterien.
- Die Ionen der Alkalimetalle Natrium und Kalium haben herausragende Funktionen im menschlichen Körper, zum Beispiel für die Bildung der Membran- und Aktionspotenziale.
Bei chemischen Reaktionen von Alkalimetallen kann der entzündliche und explosive Wasserstoff freigesetzt werden (siehe oben). Alkalimetalle können schwere Verätzungen der Haut und der Augen verursachen. Francium ist radioaktiv und kann die Strahlenkrankheit auslösen.
siehe auchLiteratur- Arzneimittel-Fachinformation (CH)
- Fachliteratur
- Lehrbücher der Chemie
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.