Wasserstoff
 Chemische Elemente
Chemische Elemente  NichtmetalleWasserstoff (H) ist das erste und einfachste chemische Element des Periodensystems. Es besteht als Protium nur aus einem Proton und einem Elektron und liegt üblicherweise molekular (H2) vor. Wasserstoff ist hochentzündlich und kann mit Sauerstoff explosiv reagieren. Er ist in fast allen pharmazeutischen Wirk- und Hilfsstoffen enthalten und wird für die Fetthärtung und für chemische Synthesen verwendet.
NichtmetalleWasserstoff (H) ist das erste und einfachste chemische Element des Periodensystems. Es besteht als Protium nur aus einem Proton und einem Elektron und liegt üblicherweise molekular (H2) vor. Wasserstoff ist hochentzündlich und kann mit Sauerstoff explosiv reagieren. Er ist in fast allen pharmazeutischen Wirk- und Hilfsstoffen enthalten und wird für die Fetthärtung und für chemische Synthesen verwendet.synonym: H, H2, Hydrogen, Hydrogenium, E 949
ProdukteWasserstoff ist als verdichtetes Gas in Druckgasflaschen im Handel.
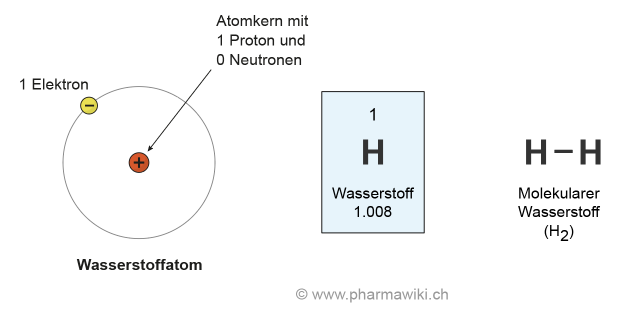
Struktur und EigenschaftenWasserstoff (H, Ordnungszahl: 1, Atommasse: 1.008) ist das erste und einfachste chemische Element im Periodensystem und das häufigste im Universum. Es gehört zu den Nichtmetallen. Auf der Erde kommt er zum Beispiel im Wasser, in allen Lebewesen und in Kohlenwasserstoffen vor. Wasserstoff liegt üblicherweise molekular, d.h. mit sich selbst gebunden als H2 vor. Die Sonne besteht hauptsächlich aus Wasserstoff. Ihre Wärme und Energie stammt von der Fusion von Wasserstoff zu Helium.
Wasserstoff (Protium) besteht nur aus einem Proton (+) und einem Elektron (-), das er als Valenzelektron abgeben kann. Dies mit Ausnahme der Isotope Deuterium (D, mit 1 Neutron) und Tritium (T, mit 2 Neutronen).
Als Hydride werden negativ geladene Wasserstoffionen bezeichnet (H-). Sie werden mit Alkali- und Erdalkalimetallen gebildet. Beispiele sind Natriumhydrid (NaH) oder Calciumhydrid (CaH2).
Wasserstoff liegt als farbloses, geruchloses und extrem entzündliches Gas mit einer geringen Dichte vor. Er ist apolar, in Wasser praktisch unlöslich und hat einen tiefen Schmelzpunkt und Siedepunkt. Wasserstoff ist zwar ungiftig, kann in höheren Konzentrationen aber zu einer Erstickung und Explosionen führen.
Wasserstoff, zum Vergrössern anklicken. Illustration © PharmaWiki
ReaktionenAufgrund der hohen Bindungsenergie des molekularen Wasserstoffs (H-H) finden chemische Reaktionen in der Regel bei hohen Temperaturen statt.
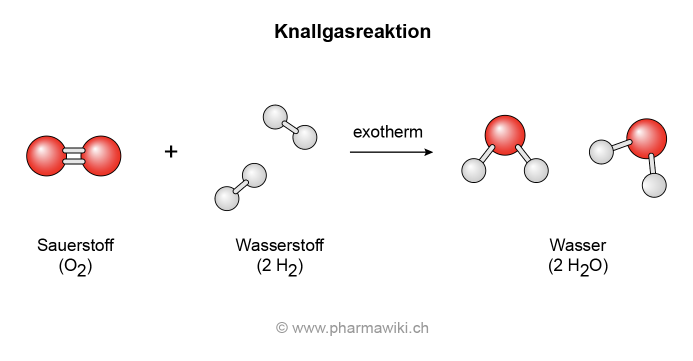
Sauerstoff reagiert exotherm und explosiv mit Wasserstoff. Dabei handelt es sich um die sogenannte Knallgasreaktion:
- 2 H2 (Wasserstoff) + O2 (Sauerstoff) → 2 H2O (Wasser)
Siehe auch unter Redox-Reaktionen.
Umgekehrt lassen sich Wasserstoff und Sauerstoff durch die Elektrolyse von Wasser herstellen:
- 2 H2O (Wasser) → 2 H2 (Wasserstoff) + O2 (Sauerstoff)
Gelangen unedle Metalle in Kontakt mit einer Säure, entsteht Wasserstoff:
- Zn (Elementares Zink) + H2SO4 (Schwefelsäure) → Zinksulfat (ZnSO4) + H2 (Wasserstoff)
Mit den Halogenen bildet Wasserstoff Säuren, zum Beispiel mit Chlorgas (Chlorknallgasreaktion):
- H2 (Wasserstoff) + Cl2 (Chlor) → 2 HCl (Chlorwasserstoff)
Knallgasreaktion mit Sauerstoff und Wasserstoff, zum Vergrössern anklicken. Illustration © PharmaWiki
AnwendungsgebieteAnwendungsgebiete in der Pharmazie (Auswahl):
- Wasserstoff ist in den meisten pharmazeutischen Wirkstoffen und Hilfsstoffen enthalten. Dies mit Ausnahme einiger anorganischer Salze.
- Für die katalytische Hydrierung ungesättigter Fettsäuren in Fetten und fetten Ölen (sogenannte Härtung).
- Wasserstoff spielt eine zentrale Rolle bei Säure-Basen-Reaktionen.
- Für chemische Synthesen.
- Für Radiopharmaka (Isotope).
Im Unterschied zu Sauerstoff ist Wasserstoff als medizinisches Gas ohne Bedeutung.
Ferner wird Wasserstoff auch als alternativer Treibstoff und zur Erzeugung und Speicherung von Energie eingesetzt.
MissbrauchWasserstoff kann als Dopingmittel zur Förderung der körperlichen Leistungsfähigkeit missbraucht werden.
siehe auchChemische Elemente, Sauerstoff, Säuren, Redox-Reaktionen, Elektrolyse, Chemische Experimente
Literatur- Fachliteratur
- Lehrbücher der Chemie
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.