Edelgase
 Chemische Elemente
Chemische Elemente  NichtmetalleEdelgase sind eine Gruppe von Gasen, welche die sechs natürlichen chemischen Elemente Helium, Neon, Argon, Krypton, Xenon und Radon umfassen. Sie sind unter Standardbedingungen geruchlos, geschmacklos, farblos, inert und nicht entzündlich und liegen im gasförmigen Aggregatzustand und elementar vor. Weil ihre Valenzelektronen die äusseren Eletronschalen vollständig belegen, sind sie sehr unreaktiv und bilden, abgesehen von wenigen Ausnahmen, kaum Verbindungen. Edelgase werden zum Beispiel als Kühlmittel, Schutzgase, für die Gaschromatographie, als Atemgase und Traggase verwendet. Das kurzlebige Radon ist radioaktiv und kann Krebserkrankungen verursachen, indem es sich in Gebäuden anreichert, in welche es aus dem Boden gelangt.
NichtmetalleEdelgase sind eine Gruppe von Gasen, welche die sechs natürlichen chemischen Elemente Helium, Neon, Argon, Krypton, Xenon und Radon umfassen. Sie sind unter Standardbedingungen geruchlos, geschmacklos, farblos, inert und nicht entzündlich und liegen im gasförmigen Aggregatzustand und elementar vor. Weil ihre Valenzelektronen die äusseren Eletronschalen vollständig belegen, sind sie sehr unreaktiv und bilden, abgesehen von wenigen Ausnahmen, kaum Verbindungen. Edelgase werden zum Beispiel als Kühlmittel, Schutzgase, für die Gaschromatographie, als Atemgase und Traggase verwendet. Das kurzlebige Radon ist radioaktiv und kann Krebserkrankungen verursachen, indem es sich in Gebäuden anreichert, in welche es aus dem Boden gelangt.synonym: Nobel gases, Inertgase
ProdukteEdelgase sind in Druckgasflaschen im Fachhandel erhältlich.
Struktur und EigenschaftenEdelgase sind chemische Elemente aus der Gruppe der Nichtmetalle, die bei Standardbedingungen gasförmig und monoatomisch vorkommen. Sie sind geruchlos, geschmacklos, farblos, inert und nicht entzündlich. Aufgrund der geringen interatomaren Wechselwirkungen haben sie tiefe Schmelzpunkte und Siedepunkte.
Die natürlichen sechs Edelgase sind:
Das sehr instabile Oganesson kann künstlich hergestellt werden.
Alle Elemente gehören zur Gruppe 18 des Periodensystems. Edelgase können aus der Luft und teilweise auch aus dem Erdgas gewonnen werden, in denen sie natürlich vorkommen. Radon entsteht beim radioaktiven Zerfall zum Beispiel aus Uran.
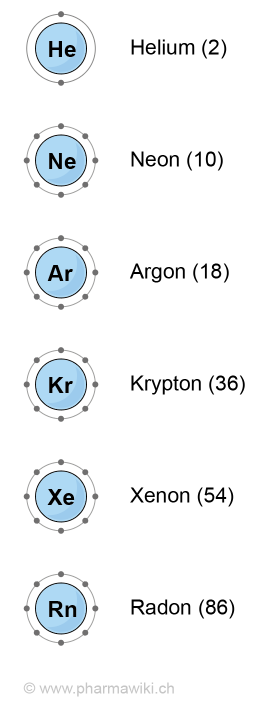
Die sechs natürlichen Edelgase mit den äussersten zwei oder acht Valenzelektronen, zum Vergrössern anklicken. Illustration © PharmaWiki
WirkungenWeil die zwei oder acht Valenzelektronen die äusseren Elektronenschalen der Edelgase ganz ausfüllen und sie die Oktettregel erfüllen („Edelgaskonfiguration“: s2 oder s2p6), haben die Edelgase unter Standardbedingungen eine sehr geringe chemische Reaktivität und sind daher praktisch inert. Deshalb sind nur wenige chemische Verbindungen bekannt, insbesondere von den höheren Elementen wie Krypton und Xenon, das zum Beispiel mit Fluor reagiert (z.B. Xenontetrafluorid). Aufgrund ihrer Unreaktivität wurden sie in der Geschichte der Chemie erst relativ spät entdeckt. Die Edelgase kommen in der Natur gediegen (elementar) vor.
Das Gegenteil der Edelgase sind die Alkalimetalle, die sich durch ihre hohe Reaktivität auszeichnen.
Anwendungsgebiete- Als Kühlmittel, zum Beispiel für die Magnetresonanztomografie.
- Als Schutzgase, in der Lebensmittelindustrie.
- Für die Gaschromatographie.
- Für Gasentladungslampen, zum Beispiel für Xenonlicht.
- In der Medizin zusammen mit Sauerstoff als Atemgas.
- Als Radiopharmaka (Isotope).
- Als Traggas für Ballone und Luftschiffe.
- Viele technische Anwendungsgebiete.
Bei einer übermässigen Inhalation besteht die Gefahr einer Erstickung, weil der Sauerstoff in der Luft durch die Edelgase verdrängt wird.
Flüssige Edelgase sind sehr kalt und können Erfrierungen verursachen. Druckgasflaschen bei einer Erwärmung explodieren.
Radon ist radioaktiv und kann Krebserkrankungen hervorrufen, wenn es aus dem Erdreich in Häuser eindringt.
siehe auchLiteratur- Arzneimittel-Fachinformation (CH)
- Fachliteratur
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.