Uran
 Chemische ElementeUran ist ein natürliches chemisches Element, das in der Natur in drei instabilen Isotopen vorkommt. Elementares Uran ist ein hartes, sehr schweres Metall, das zu den Actinoiden gehört. Das Element kommt in geringen Konzentrationen überall im Wasser, im Boden und im Gestein vor, in der Schweiz in höheren Konzentration in den Alpen. Es zeichnet sich durch seinen riesigen und instabilen Atomkern aus. Es ist radioaktiv und zerfällt über viele Isotope mit Halbwertszeiten von hunderttausenden bis Milliarden von Jahren schliesslich zu Blei. Das seltenere Uran-235 (0.7%) kann durch den Beschuss mit Neutronen gespalten werden, wobei enorm viel Energie freigesetzt wird, welche aus sterbenden Sternen stammt. Uran hat militärische und zivile Anwendungsgebiete. Es wird unter anderem für die Herstellung von Kernwaffen, von Munition, als Antrieb, für Kernkraftwerke und für die Nuklearmedizin verwendet. Die damit verbundenen Risiken für die Menschheit und die Natur sind beträchtlich.Produkte
Chemische ElementeUran ist ein natürliches chemisches Element, das in der Natur in drei instabilen Isotopen vorkommt. Elementares Uran ist ein hartes, sehr schweres Metall, das zu den Actinoiden gehört. Das Element kommt in geringen Konzentrationen überall im Wasser, im Boden und im Gestein vor, in der Schweiz in höheren Konzentration in den Alpen. Es zeichnet sich durch seinen riesigen und instabilen Atomkern aus. Es ist radioaktiv und zerfällt über viele Isotope mit Halbwertszeiten von hunderttausenden bis Milliarden von Jahren schliesslich zu Blei. Das seltenere Uran-235 (0.7%) kann durch den Beschuss mit Neutronen gespalten werden, wobei enorm viel Energie freigesetzt wird, welche aus sterbenden Sternen stammt. Uran hat militärische und zivile Anwendungsgebiete. Es wird unter anderem für die Herstellung von Kernwaffen, von Munition, als Antrieb, für Kernkraftwerke und für die Nuklearmedizin verwendet. Die damit verbundenen Risiken für die Menschheit und die Natur sind beträchtlich.ProdukteUran gelangt zum Beispiel in Form von Pellets mit Urandioxid (UO2) in den Handel. Es wurde im Jahr 1789 vom deutschen Chemiker Martin Heinrich Klaproth in Form von Uranoxid aus der Pechblende entdeckt und nach dem Planeten Uranus benannt.
Struktur und EigenschaftenUran ist ein natürlich vorkommendes, radioaktives chemisches Element mit der Ordnungszahl 92 und einer Atommasse von 238 u. Es liegt als hartes, silbergraues Metall mit einem hohen Schmelzpunkt von 1132 °C und einer hohen Dichte von 19.1 g/cm3 vor und gehört zu den Actinoiden. Uran hat 92 Protonen und 92 Elektronen, wovon 6 Valenzelektronen sind. Uran ist in sterbenden Sternen (Supernovae) und kollidierenden Neutronensternen entstanden. Die Energie, die es beinhaltet, stammt also aus den Sternen.
Uran kommt in einer tiefen Konzentration natürlich überall im Wasser, im Boden und im Gestein vor. In der Schweiz sind die Konzentrationen im Granit der Alpen am höchsten. Bekannt ist zum Beispiel das Mineral Uraninit (Pechblende, Urandioxid), das in Uranminen abgebaut wird. Es wird in der Natur nicht elementar (metallisch) gefunden.
Die drei häufigsten Isotope sind Uran-238 (99.2 %), Uran-235 (0.7 %) und Uran-234 (0.005 %). Das bei Weitem am häufigsten vorkommende Isotop Uran-238 hat 92 Protonen und 146 Neutronen (92 + 146 = 238). Uran zeichnet sich durch seinen extrem grossen und instabilen Atomkern aus. Plutonium mit 94 Protonen ist das letzte Element, das auf der Erde natürlich vorkommt.
Für die Kernspaltung wird das seltenere Isotop Uran-235 verwendet, das 92 Protonen und 143 Neutronen enthält (92 + 143 = 235).
Die drei Uranisotope haben sehr lange Halbwertszeiten von hunderttausenden bis Milliarden Jahren.
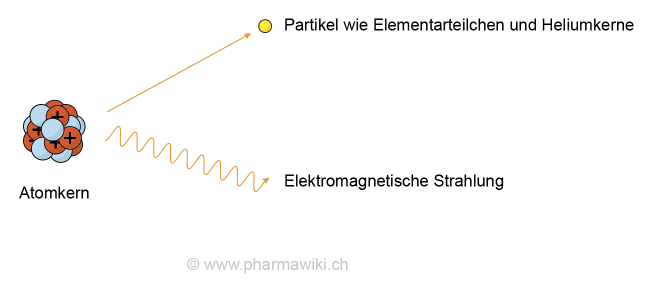
WirkungenEnde des 19. Jahrhunderts wurde die Radioaktivität von Uran von Henri Becquerel entdeckt. Das bedeutet, dass aus den Atomkernen ionisierende Strahlung freigesetzt wird. Bei Uran handelt es sich um einen Alpha-Strahler.
Uran-238 zerfällt beispielsweise in Thorium-234, in Protactinium-234, Uran-234, Thorium-230, Radium-226, Radon-222 (gasförmig), Polonium-218, Blei-214, Astat-218, Bismut-214, Polonium-214, Thallium-210, Blei-210, Bismut-210, Quecksilber-206, Thallium-206, Polonium-210 und Blei-206. Blei-206 ist nicht radioaktiv und stabil.
Uran-235 kann durch den Beschuss mit Neutronen gespalten werden, wobei enorm viel Energie freigesetzt wird (Einstein: E = mc2). Weil dabei ebenfalls Neutronen anfallen, kommt es zu der sogenannten Kettenreaktion, bei der immer weitere Kerne gespalten werden. Die Kernspaltung wurde von Otto Hahn und Fritz Straßmann im Jahr 1938 im nationalsozialistischen Deutschland entdeckt.
Die erste militärisch eingesetzte Atombombe Little Boy, die im Jahr 1945 auf die japanische Stadt Hiroshima abgeworfen wurde, enthielt 64 kg Uran, hauptsächlich Uran-235.
Radioaktivität, zum Vergrössern anklicken. Illustration © PharmaWiki
Anwendungsgebiete (Auswahl)Uran ist ein Spurenelement, das im menschlichen Körper keine bekannte Funktion hat.
Militärische Anwendungsgebiete:
- Für die Herstellung von panzerbrechender Munition.
- Antrieb, z.B. von Atom-U-Booten.
- Für die Herstellung von Kernwaffen.
- Für die Herstellung von Plutonium-Isotopen, die auch für eine Kettenreaktion geeignet sind (Plutonium-239).
Zivile Anwendungsgebiete:
- Für den Betrieb von Kernkraftwerken.
- In der Flugzeugindustrie.
- Früher als Färbemittel für unter UV-Licht fluoreszierendem Uranglas (gelb bis grün) und Urankeramik (gelb bis orange).
- Für die Stromversorgung von Raumsonden.
- Für die Herstellung von Isotopen für die Nuklearmedizin.
Mit Lebensmitteln nehmen wir täglich etw 1 bis 4 µg Uran zu uns, vor allem mit dem Trinkwasser.
Unerwünschte WirkungenUran ist aus verschiedenen Gründen gefährlich. Einerseits ist es akut toxisch, wenn es überdosiert eingenommen wird. Es ist schädlich, weil es ionisierende Strahlung freisetzt und die Strahlenkrankheit verursacht und andererseits, weil es sich um ein Schwermetall handelt. Bei einer Überdosierung, zum Beispiel mit dem Trinkwasser, steht die Nierentoxizität im Vordergrund, nicht die ionisierende Strahlung].
Radonisotope (Radon-222) sind gasförmig und können Krebserkrankungen verursachen, wenn sich das Gas in Häusern ansammelt (siehe unter Radon).
Bei Nuklearunfällen in Atomkraftwerken können riesige Gebiete mit radioaktiven Produkten verseucht werden, was die Strahlenkrankheit auslöst. Die zwei bekanntesten Unfälle sind die Nuklearkatastrophe von Tschernobyl (1986) und von Fukushima (2011). Die weltweit gelagerten Kernwaffen haben als Massenvernichtungswaffen das Potenzial, die Menschheit mehrfach zu vernichten. Schliesslich besteht auch die Gefahr terroristischer Angriffe auf Atomanlagen oder Angriffe mit schmutzigen Bomben, welche zu Strahlenschäden führen.
siehe auchRadioaktivität, Radon, Energie, Elektromagnetische Strahlung, Krebs, Plutonium
Literatur- Fachliteratur
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.