Erdalkalimetalle
 Chemische Elemente
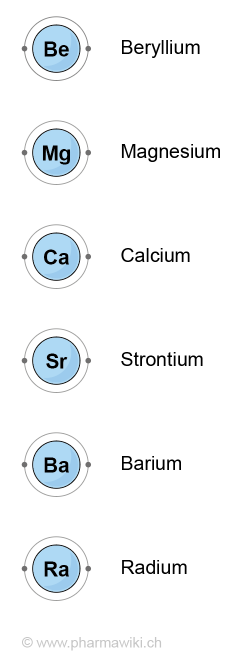
Chemische Elemente  MetalleErdalkalimetalle sind eine Gruppe chemischer Elemente der zweiten Hauptgruppe des Periodensystems. Dazu gehören Beryllium, Magnesium, Calcium, Strontium, Barium und Radium. Es sind Leichtmetalle mit einer vergleichsweise geringen Dichte, einem tiefen Schmelz- und Siedepunkt. Erdalkalimetalle haben zwei Elektronen in der äussersten Valenzschale, die sie abgeben, um die Edelgaskonfiguration zu erreichen. Erdalkalimetalle reagieren mit verschiedenen Nichtmetallen wie Sauerstoff, Halogenen und Stickstoff.
MetalleErdalkalimetalle sind eine Gruppe chemischer Elemente der zweiten Hauptgruppe des Periodensystems. Dazu gehören Beryllium, Magnesium, Calcium, Strontium, Barium und Radium. Es sind Leichtmetalle mit einer vergleichsweise geringen Dichte, einem tiefen Schmelz- und Siedepunkt. Erdalkalimetalle haben zwei Elektronen in der äussersten Valenzschale, die sie abgeben, um die Edelgaskonfiguration zu erreichen. Erdalkalimetalle reagieren mit verschiedenen Nichtmetallen wie Sauerstoff, Halogenen und Stickstoff. synonym: Alkaline earth metal
ProdukteErdalkalimetalle sind für Fachpersonen im Fachhandel erhältlich.
Struktur und EigenschaftenErdalkalimetalle sind eine Gruppe chemischer Elemente der zweiten Hauptgruppe des Periodensystems. Sie liegen elementar als glänzende, silberne bis weisse Metalle vor und sie sind reaktiv.
Die sechs Elemente sind:
Wie die Alkalimetalle haben auch die Erdalkalimetalle im Vergleich mit anderen Metallen geringe Dichten sowie tiefe Schmelzpunkte und Siedepunkte. Sie werden deshalb zu den Leichtmetallen gezählt.
Äusserste Valenzelektronen der Erdalkalimetalle, zum Vergrössern anklicken. Illustration © PharmaWiki
ReaktionenErdalkalimetalle haben in der äussersten Schale zwei Valenzelektronen (s2), welche sie als Reduktionsmittel abgeben können. Sie sind anschliessend zweifach geladen. Es handelt sich um eine Redox-Reaktion. Erdalkalimetalle sind etwas weniger reaktiv als die Alkalimetalle.
- Ca (Calcium, elementar) → Ca2+ (Calcium, Kation) + 2 e- (Elektron)
Erdalkalimetalle reagieren mit Nichtmetallen wie den Halogenen, Sauerstoff und Schwefel und bilden entsprechende Salze.
Reaktion mit Wasser:
- Ca: (Calcium elementar) + 2 H2O (Wasser) → Ca(OH)2 (Calciumhydroxid) + H2 (Wasserstoff)
Reaktion mit Sauerstoff:
- 2 Mg: (Magnesium elementar) + O2 (Sauerstoff) → 2 MgO (Magnesiumoxid)
Beryllium hat eine andere Chemie als die übrigen Erdalkalimetalle und bildet kovalente Verbindungen.
AnwendungsgebieteDie Salze der Erdalkalimetalle sind wichtige Wirkstoffe und Hilfsstoffe in der Pharmazie. Am wichtigsten sind Magnesium und Calcium.
Unerwünschte WirkungenErdalkalimetalle sind reaktiv. Beim Kontakt mit anderen Stoffen wie beispielsweise Wasser entstehen brennbare und explosive Gase (Wasserstoff). Bei einem Brand darf deshalb kein Wasser zum Löschen verwendet werden.
siehe auchLiteratur- Arzneimittel-Fachinformation (CH)
- Fachliteratur
- Lehrbücher der Chemie
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
Weitere Informationen