Katalysatoren
 Chemische ReaktionenKatalysatoren sind Stoffe oder Verbindungen, welche die Geschwindigkeit einer chemischen Reaktion erhöhen, indem sie die Aktivierungsenergie reduzieren. Sie werden während der Reaktion nicht verändert, nicht verbraucht und sie sind nicht Teil des Produkts. Auf das Reaktionsgleichgewicht haben sie keinen Einfluss. In der Regel ist nur eine geringe Menge erforderlich. Enzyme sind Biokatalysatoren, welche für das Leben auf der Erde, die Biochemie und die Nahrungsmittelindustrie von essenzieller Bedeutung sind und auch als Arzneimittel verwendet werden.
Chemische ReaktionenKatalysatoren sind Stoffe oder Verbindungen, welche die Geschwindigkeit einer chemischen Reaktion erhöhen, indem sie die Aktivierungsenergie reduzieren. Sie werden während der Reaktion nicht verändert, nicht verbraucht und sie sind nicht Teil des Produkts. Auf das Reaktionsgleichgewicht haben sie keinen Einfluss. In der Regel ist nur eine geringe Menge erforderlich. Enzyme sind Biokatalysatoren, welche für das Leben auf der Erde, die Biochemie und die Nahrungsmittelindustrie von essenzieller Bedeutung sind und auch als Arzneimittel verwendet werden.synonym: Katalyse, Katalysieren
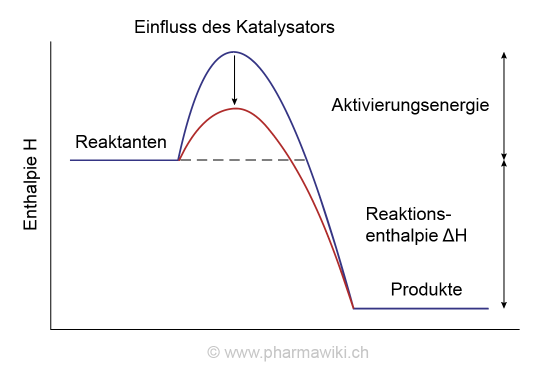
Definition und EigenschaftenKatalysatoren sind Stoffe oder Verbindungen, welche die Geschwindigkeit einer chemischen Reaktion erhöhen, ohne das Reaktionsgleichgewicht zu beeinflussen. Im Unterschied zu den Reaktanten werden sie nicht verändert und nicht verbraucht. Sie erscheinen nicht im Produkt der Reaktion. In der Regel sind nur kleine Mengen erforderlich. Katalysatoren reduzieren die Aktivierungsenergie, welche für die Einleitung der Reaktion erforderlich ist.
Einfluss von Katalysatoren auf die Aktivierungsenergie, zum Vergrössern anklicken. Illustration © PharmaWiki
Katalysatoren fixieren die Reaktanten beispielsweise in der erforderlichen Konformation, welche die Reaktion verbessert. Oder sie gehen mit einem Substrat eine Reaktion ein, welche den weiteren Reaktionsverlauf erleichtert:
- A + K → A-K
- A-K + B → A-B + K
Ein typisches Beispiel für eine Katalyse ist die Knallgasreaktion mit Wasserstoff und Sauerstoff, welche durch den Katalysator Platin spontan eingeleitet wird. Auch die Zersetzung von Wasserstoffperoxid mit Metallen und Metallsalzen wird oft als chemisches Experiment vorgezeigt.
Enzyme sind Proteine und natürliche Biokatalysatoren. Sie sind für alles Leben auf der Erde essenziell, zum Beispiel für die Synthese und den Abbau der Biopolymere wie der Polysaccharide, Nukleinsäuren und Proteine. Katalysatoren spielen auch in der Technik, für die Lebensmittelindustrie, in der Biochemie, bei der Synthese von Chemikalien und bei der Reduktion der Schadstoffemission von Verbrennungsmotoren eine zentrale Rolle. Und schliesslich wird der Abbau toter Lebewesen von mikrobiellen Enzymen katalysiert.
Es existieren auch negative Katalysatoren, welche die Aktivierungsenergie erhöhen und die Reaktionsgeschwindigkeit senken.
Es kann zwischen homogenen und heterogenen Katalysatoren unterschieden werden. Homogene haben denselben Aggregatzustand wie die Reaktanten, die heterogenen einen unterschiedlichen.
Beispiele für Katalysatoren- Enzyme
- Mangandioxid
- Viele Metalle, z.B. Platin, Palladium, Nickel, Eisen
- Eisenoxide
- Cobaltchlorid
- Pflanzenasche (Verbrennung von Zucker)
- Säuren, z.B. Schwefelsäure
- Vanadiumpentoxid
- Fachliteratur
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.