Dichte
 MaterieDas gleiche Volumen unterschiedlicher Stoffe hat eine andere Masse. So ist etwa Medizinalbenzin leichter als Ethanol und Ethanol ist leichter als Wasser. Diese Stoffeigenschaft wird als Dichte bezeichnet. Die Dichte ist das Verhältnis von Masse und Volumen.
MaterieDas gleiche Volumen unterschiedlicher Stoffe hat eine andere Masse. So ist etwa Medizinalbenzin leichter als Ethanol und Ethanol ist leichter als Wasser. Diese Stoffeigenschaft wird als Dichte bezeichnet. Die Dichte ist das Verhältnis von Masse und Volumen.synonym: Massendichte, Rho
DefinitionAus dem Alltag ist uns bekannt, dass die gleichen Volumen unterschiedlicher Stoffe nicht dieselbe Masse haben. Ein Litermass voller Daunen ist wesentlich leichter als ein Litermass, das mit Zucker gefüllt ist. Neuschnee ist leichter als Eis und Eis ist etwas leichter als Wasser, obwohl sie alle H2O enthalten. Als Mass für diese unterschiedlichen Substanzeigenschaften wird die Dichte verwendet.
Die Dichte (ρ, Rho) ist definiert als Quotient der Masse (m) einer Substanz und ihrem Volumen (V):
Die SI-Einheit der Dichte ist Kilogramm pro Kubikmeter (kg/m3). Alternativ wird auch häufig g/cm3 verwendet. Ein Kubikzentimeter (cm3) entspricht einem Milliliter.
Je höher die Dichte ist, desto schwerer ist dasselbe Volumen. Das schwere Edelmetall Gold hat zum Beispiel eine Dichte von 19.3 g/cm3.
Die Dichte hängt unter anderem von den chemischen Elementen und Isotopen in der Substanz, von der Kompression, vom Aggregatszustand und davon ab, wie eng die Moleküle oder Teilchen in der Substanz zusammen vorliegen.
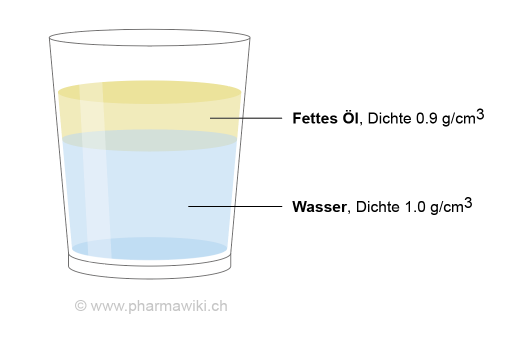
Ein fettes Öl schwimmt auf Wasser, weil seine Dichte etwas geringer ist. Zum Vergrössern anklicken. Illustration © PharmaWiki
Berechnung der MasseDie Masse einer Substanz kann aus ihrer Dichte und dem Volumen wie folgt berechnet werden:
Berechnung des VolumensUmgekehrt wird das Volumen so berechnet:
Die Dichte von Wasser ist 1 g/cm3Die Dichte von Wasser beträgt bei 3.98 °C (also etwa 4 °C) und einem Druck von einer Atmosphäre 1000 kg/m3 oder 1 g/cm3. Weil die Dichte von Wasser also 1 g/cm3 ist, entsprechen sich Masse und Volumen. Das Volumen von 1 Liter Wasser entspricht der Masse von 1 kg. Wobei diese Angaben wie bereits erwähnt von äusseren Einflüssen abhängig sind.
Die Dichte ist temperaturabhängig. Weil sich Stoffe bei steigender Temperatur in der Regel ausdehnen, das Volumen also grösser wird, sinkt die Dichte mit steigender Temperatur. Wasser ist eine prominente Ausnahme. Es ist als Flüssigkeit schwerer als Eis.
Dichte als SubstanzeigenschaftenDie Dichte wird als charakteristische Eigenschaft einer Substanz zum Beispiel in der Analytik verwendet. Durch die Messung der Dichte kann, zusammen mit anderen Anhaltspunkten, ein Rückschluss auf Art einer Substanz gezogen werden.
Dichte beim AbfüllenEthanol 70% mit Kampfer hat eine Dichte von 0.88 g/cm3. Sie ist geringer als diejenige von Wasser. Deshalb haben 100 g ein grösseres Volumen von 113.6 ml. Werden als 100 g abgefüllt, reicht ein Gefäss zu 100 ml nicht aus, um diese Masse aufzunehmen. Das gilt für alle Flüssigkeiten mit einer Dichte unter 1.
Auch beim Abfüllen von Arzneidrogen spielt die Dichte eine wichtige Rolle. So haben beispielsweise Wurzeln eine höhere Dichte als Blüten. Dieselbe Masse nimmt deshalb ein sehr unterschiedliches Volumen ein.
Beispiele in der Pharmazie- Quecksilber: 13.5 g/cm3
- Aluminium: 2.7 g/cm3
- Natriumhydrogencarbonat: 2.20 g/cm3
- Natriumchlorid: 2.16 g/cm3
- Schwefelsäure 95%: 1.84 g/cm3
- Glycerol 85%: 1.23 g/cm3
- Macrogol 4000: 1.2 g/cm3
- Wasserstoffperoxid 30%: 1.1 g/cm3
- Propylenglycol: 1.04 g/cm3
- Wasser: 1.0 g/cm3
- Fette Öle: ca. 0.9 g/cm3
- Ethanol 70%: 0.88 g/cm3
- Dickflüssiges Paraffin: 0.86 g/cm3
- Ethanol 96%: 0.81 g/cm3
- Vaseline: ca. 0.8 g/cm3
- Isopropanol: 0.78 g/cm3
- Wundbenzin, Fleckenbenzin: 0.68 g/cm3
Masse, Volumen, Konzentration, Verdünnungen, Materie
Literatur- Europäisches Arzneibuch PhEur
- Fachliteratur
- Lehrbücher der Chemie
- Lehrbücher der pharmazeutischen Technologie
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.