Calciumhydroxid
 BasenCalciumhydroxid ist ein basisches Calciumsalz, das unter Zugabe von Wasser aus Calciumoxid hergestellt wird. Es hat basische, ätzende und antimikrobielle Eigenschaften und wird unter anderem als Säureregulator für Lebensmittel, in der Zahnmedizin und für chemische Experimente verwendet (Nachweis von Kohlenstoffdioxid). Calciumhydroxid kann bei einem unsachgemässen Gebrauch die Atemwege reizen sowie Hautreizungen und schwere Augenschäden verursachen. Die entsprechenden Vorsichtsmassnahmen müssen beachtet werden.
BasenCalciumhydroxid ist ein basisches Calciumsalz, das unter Zugabe von Wasser aus Calciumoxid hergestellt wird. Es hat basische, ätzende und antimikrobielle Eigenschaften und wird unter anderem als Säureregulator für Lebensmittel, in der Zahnmedizin und für chemische Experimente verwendet (Nachweis von Kohlenstoffdioxid). Calciumhydroxid kann bei einem unsachgemässen Gebrauch die Atemwege reizen sowie Hautreizungen und schwere Augenschäden verursachen. Die entsprechenden Vorsichtsmassnahmen müssen beachtet werden.synonym: Calcii hydroxidum PhEur, Calcium hydroxide, E 526, Löschkalk, Gelöschter Kalk, Kalziumhydroxid, Kalkhydrat, Calciumdihydroxid
ProdukteCalciumhydroxid ist in Apotheken und Drogerien erhältlich. Es wird auch als Löschkalk oder gelöschter Kalk bezeichnet.
Struktur und EigenschaftenCalciumhydroxid (Ca(OH)2, Mr = 74.1 g/mol) liegt als weisses, feines und geruchloses Pulver vor, das in Wasser praktisch unlöslich ist. Es handelt sich um eine Base mit einem pKb(1) von 1.37, die zum Beispiel mit der Salzsäure reagiert:
- Ca(OH)2 (Calciumhydroxid) + 2 HCl (Salzsäure) → CaCl2 (Calciumchlorid) + 2 H2O (Wasser)
Dabei wird im Unterschied zu den Carbonaten kein Kohlenstoffdioxid freigesetzt.
Calciumhydroxid kann aus Calciumoxid mit Wasser hergestellt werden. Diese Reaktion ist stark exotherm:
- CaO (Calciumoxid) + H2O (Wasser) → Ca(OH)2 (Calciumhydroxid)
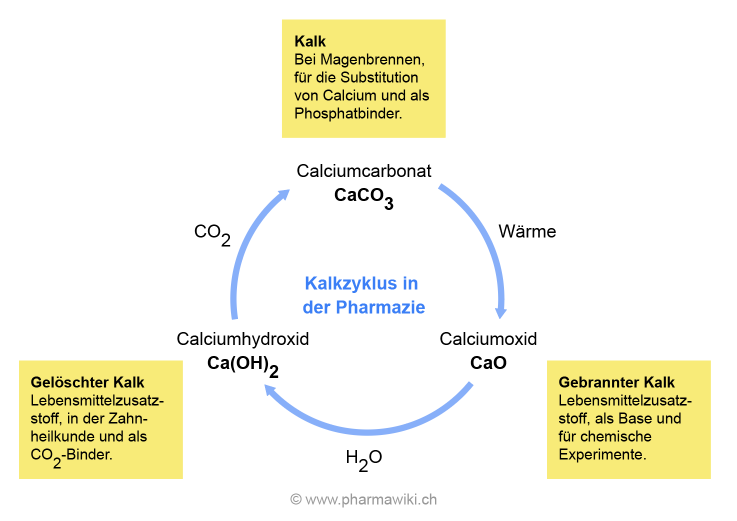
Der Kalkzyklus in der Pharmazie, zum Vergrössern anklicken. Illustration © PharmaWiki
WirkungenCalciumhydroxid hat basische, ätzende, antiseptische und antifungale Eigenschaften.
AnwendungsgebieteZu den Anwendungsgebieten gehören (Auswahl):
- In der Lebensmittelindustrie als Säureregulator.
- In der Zahnheilkunde.
- Im Atemkalk von Narkosegeräten.
- Früher wie Magnesiumhydroxid bei Magenbrennen und saurem Aufstossen. In der Schweiz sind keine Arzneimittel im Handel.
- Zum Streichen von Bäumen gegen Frost und Tierfrass.
- Betelnüsse werden zusammen mit Calciumhydroxid gekaut.
Für chemische Experimente im Unterricht (Nachweis von Kohlenstoffdioxid):
Wird Kohlenstoffdioxid in eine wässrige Lösung von Calciumhydroxid eingeleitet, zum Beispiel in Form von Atemluft, bildet sich ein Niederschlag von Calciumcarbonat (Kalk):
- Ca(OH)2 (Calciumhydroxid) + CO2 (Kohlenstoffdioxid) → CaCO3 (Calciumcarbonat) + H2O (Wasser)
Die Bildung von Calciumcarbonat ist eine Folge der → Kohlensäure und ihrer Dissoziation zu Hydrogencarbonat und Carbonat in wässriger Lösung.
Unerwünschte WirkungenCalciumhydroxid kann bei einem unsachgemässen Gebrauch die Atemwege reizen sowie Hautreizungen und schwere Augenschäden verursachen. Die entsprechenden Vorsichtsmassnahmen im Sicherheitsdatenblatt müssen beachtet werden (z.B. das Tragen von Handschuhen, einer Schutzbrille und Schutzkleidung).
siehe auchCalciumcarbonat, Calciumoxid, Natriumhydroxid, Kaliumhydroxid, Basen, Kohlenstoffdioxid, Betelnüsse
Literatur- Arzneimittel-Fachinformation (CH)
- Europäisches Arzneibuch PhEur
- Fachliteratur
- Lehrbücher der Chemie
- Lexika der Pharmazie
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.