Essigsäure
 Säuren
Säuren  CarbonsäurenDie Essigsäure ist eine einfache und schwache Carbonsäure, die in allen Lebewesen vorkommt und zum Beispiel bei der bakteriellen Essigsäuregärung aus Alkohol entsteht. Sie ist in einer tiefen Konzentration im Essig enthalten. Praktisch reine und wasserfreie Essigsäure wird als Eisessig bezeichnet. Essigsäure wird unter anderem als Desinfektionsmittel, als Reinigungsmittel, als Ätzmittel, Reagens und für die Herstellung von Wirkstoffsalzen verwendet. In hohen Konzentrationen ist sie ätzend und als Reinstoff entzündbar.
CarbonsäurenDie Essigsäure ist eine einfache und schwache Carbonsäure, die in allen Lebewesen vorkommt und zum Beispiel bei der bakteriellen Essigsäuregärung aus Alkohol entsteht. Sie ist in einer tiefen Konzentration im Essig enthalten. Praktisch reine und wasserfreie Essigsäure wird als Eisessig bezeichnet. Essigsäure wird unter anderem als Desinfektionsmittel, als Reinigungsmittel, als Ätzmittel, Reagens und für die Herstellung von Wirkstoffsalzen verwendet. In hohen Konzentrationen ist sie ätzend und als Reinstoff entzündbar.synonym: Acidum aceticum, Acidum aceticum glaciale PhEur, E 260, Ethansäure, Methancarbonsäure, Acetic acid, E 260, Ethanoic acid, AcOH
ProdukteDie Essigsäure ist als wässrige Lösung in verschiedenen Konzentrationen in Apotheken und Drogerien erhältlich. Sie kommt auch im Essig vor.
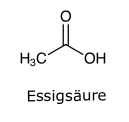
Struktur und EigenschaftenDie Essigsäure (C2H4O2, Mr = 60.1 g/mol) oder CH3-COOH ist nach der Ameisensäure die einfachste Carbonsäure. Sie besteht aus einer Methyl- und Carboxylgruppe. Sie liegt als Reinstoff als klare, flüchtige, farblose Flüssigkeit und aufgrund des Schmelzpunktes von etwa 17 °C auch als kristalline Masse vor und ist mit Wasser mischbar. Die Essigsäure hat einen stechenden Geruch und ist ätzend.
In den Arzneibüchern werden unter anderem die folgenden Konzentrationen unterschieden (Beispiele):
- Essigsäure 99 % (Acidum aceticum glaciale PhEur) - Eisessig, wasserfreie Essigsäure
- Essigsäure 30 % (Acidum aceticum 30 per centum PH) - Verdünnte Essigsäure
Ihre Salze und Ester werden als Acetate bezeichnet, zum Beispiel die Hilfsstoffe Natriumacetat und Kaliumacetat. Auch einige pharmazeutische Wirkstoffe liegen in dieser Form vor. Der lateinische Name ist von Acetum (lat. Essig) abgeleitet.
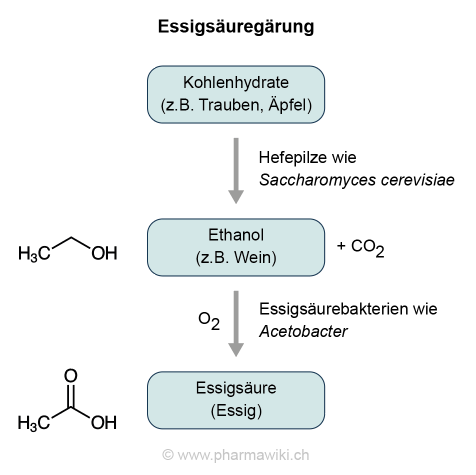
Die Essigsäure ist eine natürliche Substanz, die zum Beispiel nach der alkoholischen Gärung aus Ethanol (Alkohol) durch eine bakterielle Oxidation entsteht. Man spricht von der Essigsäuregärung oder -Fermentation, die in den Essigsäurebakterien (z.B. Acetobacter) stattfindet. Im Essig ist sie typischerweise in einer Konzentration von mindestens 4.5 % bis 5 % enthalten, wobei der Säuregehalt der Produkte unterschiedlich ist.
Ethanol + Sauerstoff (O2) → Essigsäure + Wasser (H2O)
Die Essigsäure kommt als Stoffwechselprodukt in allen Lebewesen vor. Mit einem pKa von 4.76 ist sie nur eine schwache Säure.
Essigsäuregärung, zum Vergrössern anklicken. Illustration © PharmaWiki
WirkungenEssigsäure (ATC G01AD02  , ATC S02AA10
, ATC S02AA10  ) hat saure, ätzende, reizende, konservierende und antimikrobielle Eigenschaften.
) hat saure, ätzende, reizende, konservierende und antimikrobielle Eigenschaften.
Für die Essigsäure existieren in geeigneten Verdünnungen zahlreiche Anwendungsgebiete (Auswahl):
- Als Desinfektionsmittel.
- Als Ätzmittel, bei Warzen und Hühneraugen.
- Als durchblutungsförderndes Mittel.
- Für die Herstellung von Wirkstoffsalzen.
- Für chemische Synthesen (z.B. Acetylierung), als Reagens und Lösungsmittel.
- Als Hilfsstoff für die Einstellung des pH-Werts, als Puffer mit Natriumacetat.
- Im Essig als Lebensmittel, zum Beispiel für die Herstellung von Salatsaucen, als Konservierungsmittel, für Essigkonserven und Mayonnaise.
- Als Reinigungsmittel, zum Entkalken.
Das Gefahrenpotenzial der Essigsäure ist von ihrer Konzentration abhängig. Eisessig (99 %) ist ätzend und kann Verätzungen der Haut, der Schleimhäute und der Augen verursachen. Ausserdem muss beachtet werden, dass sowohl die Flüssigkeit als auch ihre Dämpfe entzündbar sind! Entsprechende Vorsichtsmassnahmen müssen beachtet werden. Sie finden sich im Sicherheitsdatenblatt. Lösungen mit einer tieferen Konzentration sind nicht entzündbar, aber nach wie vor reizend oder ätzend.
siehe auchEssig, Ethylacetat, Ameisensäure, Säuren, Essigsäureanhydrid, Natriumacetat, Kaliumacetat, Carbonsäuren
Literatur- Arzneimittel-Fachinformation (CH)
- Europäisches Arzneibuch PhEur
- Lehrbücher der Lebensmitteltechnologie
- Lehrbücher der Pharmazie
- Pharmacopoea Helvetica
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
Weitere Informationen