Alkane
 Stoffgruppen
Stoffgruppen  KohlenwasserstoffeAlkane sind organische Verbindungen, die ausschliesslich aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. Sie sind nicht aromatisch und gesättigt. In der Pharmazie spielen sie eine wichtige Rolle als Grundgerüste zahlreicher Wirk- und Hilfsstoffe. Medizinalbenzin, Vaseline und Paraffine bestehen aus Alkanen.
KohlenwasserstoffeAlkane sind organische Verbindungen, die ausschliesslich aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. Sie sind nicht aromatisch und gesättigt. In der Pharmazie spielen sie eine wichtige Rolle als Grundgerüste zahlreicher Wirk- und Hilfsstoffe. Medizinalbenzin, Vaseline und Paraffine bestehen aus Alkanen. synonym: Alkyl, Alkylgruppe
DefinitionAlkane sind organische Verbindungen, die ausschliesslich aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. Sie gehören zu den Kohlenwasserstoffen und enthalten nur C-C- und C-H-Bindungen. Alkane sind nicht aromatisch und gesättigt. Es wird von aliphatischen Verbindungen gesprochen. Die allgemeine Formel azyklischer Alkane ist CnH2n+2.
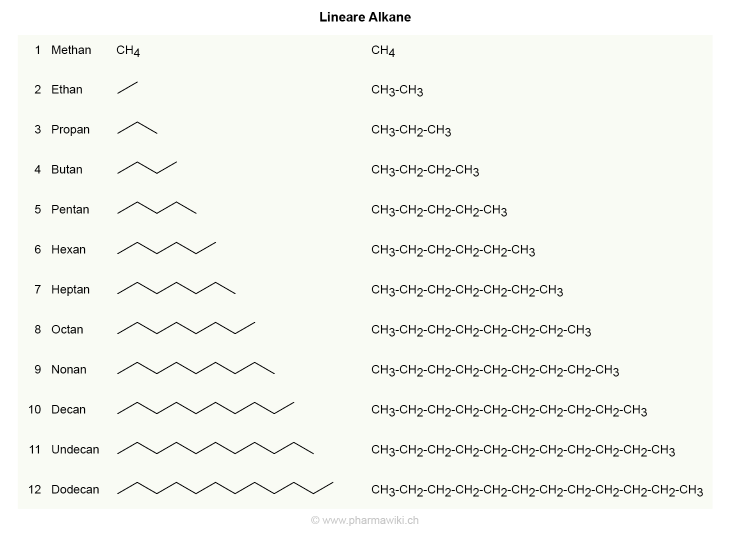
Die einfachsten Alkane sind die linearen Alkane mit einem (Methan), zwei (Ethan), drei (Propan) oder vier (Butan) Kohlenstoffatomen. Mit zunehmender Grösse steigt die Zahl der möglichen Konstitutionsisomere stark an.
Alkane können unverzweigt (n-Alkane) oder verzweigt sein. Die Cycloalkane liegen als Ringe vor, zum Beispiel Cylopentan oder Cyclohexan.
Ungesättigte Alkane mit Doppelbindungen werden als Alkene und mit Dreifachbindungen als Alkine bezeichnet.
Vertreter (Auswahl)In Klammern ist der Name der Substituenten aufgelistet.
n-Alkane:
- Methan (Methyl)
- Ethan (Ethyl)
- Propan (Propyl)
- Butan (Butyl)
- Pentan (Pentyl)
- Hexan (Hexyl)
- Heptan (Heptyl)
- Octan (Octyl)
- Nonan (Nonyl)
- Decan (Decyl)
- Undecan (Undecyl)
- Dodecan (Dodecyl)
Cycloalkane:
- Cyclpropan (Cyclopropyl)
- Cyclobutan (Cyclobutyl)
- Cyclohexan (Cyclohexyl)
- Cycloheptan (Cycloheptyl)
- etc.
Lineare Alkane, zum Vergrössern anklicken. Illustration © PharmaWiki
NomenklaturAlkane tragen das Suffix -an, Alkene das Suffix -en und Alkine das Suffix -in. Den Cycloalkanen wird das Präfix Cyclo- vorangestellt. Für das genaue Vorgehen bezüglich der Nomenklatur verweisen wir auf die Literatur.
Eigenschaften- Weil ihnen elektronegative Atome wie Sauerstoff und Stickstoff fehlen, bilden Alkane keine Wasserstoffbrücken aus und haben einen tiefen Siedepunkt. Dies im Unterschied zu den Alkoholen oder Aminen.
- Alkane mit einer geringen Molekülmasse liegen gasförmig vor. Höhere Alkane sind flüssig, halbfest und fest.
- Mit steigender Molekülmasse steigen die Siede- und Schmelzpunkte an. Der Grund liegt in den zunehmenden Van-der-Waals-Kräften.
- Alkane sind hydrophob (apolar) und deshalb wasserunlöslich.
- Flüssige Alkane haben eine Dichte < 1 g/cm3 (typischerweise 0.7 g/cm3) und schwimmen deshalb auf dem Wasser.
- Alkane können brennbar und explosiv sein.
Aufgrund des Fehlens an funktionellen Gruppen sind die Alkane relativ unreaktiv.
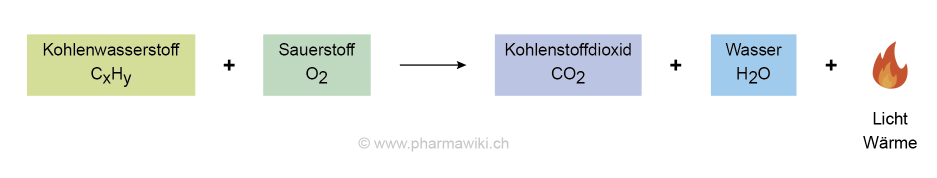
Verbrennung von Alkanen:
- CH4 (Methan) + 2 O2 (Sauerstoff) → CO2 (Kohlenstoffdioxid) + 2 H2O (Wasser)
Weitere Reaktionen:
- Halogenierungen und andere Substitutionen
- Cracking (Aufspalten, Pyrolyse)
Zahlreiche pharmazeutische Wirkstoffe und Hilfsstoffe sind substituierte Alkane. Sie spielen eine wichtige Rolle als „Grundgerüst“ und als Substituenten. Sie werden auch als Lösungs- und Extraktionsmittel verwendet. Wundbenzin, Vaseline, Paraffine und Petrolether bestehen aus Alkanen.
Unerwünschte WirkungenAlkane sind die Hauptbestandteile der fossilen Energieträger wie Erdöl, Erdgas und entsprechenden Produkten wie Benzin und Diesel. Ihre Verbrennung führt zur Bildung von Kohlenstoffdioxid (CO2), das für die Klimaerwärmung hauptverantwortlich ist.
Verbrennung eines Kohlenwasserstoffs, zum Vergrössern anklicken. Illustration © PharmaWiki
siehe auchAlkene, Alkine, Erdöl, Petrolether, Benzine, Schnüffelstoffe, Kohlenwasserstoffe
Literatur- Arzneimittel-Fachinformation
- Fachliteratur
- IUPAC
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.