Hydroxygruppe
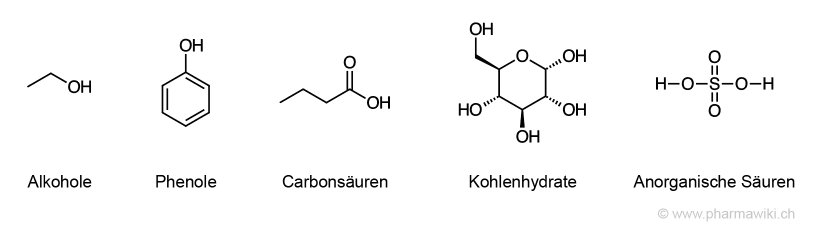
 Funktionelle GruppenDie Hydroxygruppe ist eine funktionelle Gruppe mit der allgemeinen Struktur -OH. Ein Rest ist an ein Sauerstoffatom mit zwei freien Elektronenpaaren und einem Wasserstoffatom gebunden. Die Hydroxygruppe kommt unter anderem in Alkoholen, Phenolen, Carbonsäuren, Kohlenhydraten und anorganischen Säuren vor. Eine wesentliche Eigenschaft ist die Bildung starker intermolekularer Wechselwirkungen, der Wasserstoffbrücken.
Funktionelle GruppenDie Hydroxygruppe ist eine funktionelle Gruppe mit der allgemeinen Struktur -OH. Ein Rest ist an ein Sauerstoffatom mit zwei freien Elektronenpaaren und einem Wasserstoffatom gebunden. Die Hydroxygruppe kommt unter anderem in Alkoholen, Phenolen, Carbonsäuren, Kohlenhydraten und anorganischen Säuren vor. Eine wesentliche Eigenschaft ist die Bildung starker intermolekularer Wechselwirkungen, der Wasserstoffbrücken.synonym: Hydroxylgruppe, OH-Gruppe, R-OH, Hydroxy group, -OH
Definition und StrukturDie Hydroxygruppe ist eine funktionelle Gruppe, die aus einem Wasserstoffatom H und einem Sauerstoffatom O besteht, das mit einem Rest R verbunden ist: R-OH. Der Sauerstoff trägt zwei Lone Pairs, also zwei freie Elektronenpaare.
Verschiedene Stoffgruppen enthalten Hydroxygruppen. Dazu gehören:
Das Anion HO- wird als Hydroxid bezeichnet. Es kommt beispielsweise in der starken Base Natriumhydroxid (NaOH) vor.
Das allgemeine Suffix der Hydroxygruppe ist -ol. Die Bezeichnung Hydroxylgruppe sollte heute vermieden werden. Sie bezieht sich auf das Radikal (·OH).
Die Hydroxygruppe ist ein elementarer Bestandteil zahlreicher organischer Moleküle und für das Leben auf der Erde in jeder Hinsicht essenziell.
Einige wenige Beispiele von Verbindungen mit Hydroxygruppen sind zum Beispiel Ethanol, Glucose, Cellulosen, Phenol, Saccharose, Betablocker, Stärke, Glycerol, Fettsäuren, Loperamid und Morphin.
Stoffgruppen mit der Hydroxygruppe, zum Vergrössern anklicken. Illustration © PharmaWiki
EigenschaftenEine wesentliche Eigenschaft von Hydroxygruppen ist ihre Fähigkeit, starke intermolekulare Wechselwirkungen und insbesondere Wasserstoffbrücken auszubilden. Dies ist der Grund, weshalb beispielsweise die Alkohole einen im Vergleich höheren Schmelzpunkt und Siedepunkt aufweisen als vergleichbare Alkane oder Ether.
Die tiefere Ursache ist die Polarität der Bindung zwischen dem Wasserstoff- und Sauerstoffatom. Der Sauerstoff hat eine höhere Elektronegativität und zieht das Elektronenpaar etwas näher zu sich. Daraus resultiert eine leicht negative Ladung (δ-) auf dem Sauerstoff und eine leicht positive Ladung (δ+) auf dem Wasserstoff.
Die aromatischen Phenole sind stärker sauer als die Alkohole. Der Grund liegt in der Delokalisierung der negativen Ladung durch die Aromaten.
Verbindungen mit Hydroxygruppen sind oft hydrophil und wasserlöslich, weil sie mit den Wassermolekülen Wasserstoffbrücken ausbilden.
Chemische Reaktionen- Hydroxygruppen können zu Aldehyden und zu Carbonsäuren oxidiert werden.
- Stoffe mit einer Hydroxygruppen sind Nukleophile und Substrate für einen nukleophilen Angriff.
- Alkohole und Carbonsäuren bilden zusammen Ester.
Zahlreiche pharmazeutische Wirkstoffe, Hilfsstoffe und Drug Targets enthalten Hydroxygruppen.
Literatur- Fachliteratur
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
PharmaWiki mit Google durchsuchen.