Natriumchlorid
 Arzneimittelgruppen
Arzneimittelgruppen  Salze / HilfsstoffeNatriumchlorid ist die wissenschaftliche Bezeichnung für das Salz im Speisesalz, welches aus Natrium- und Chloridionen im Verhältnis 1:1 besteht. Es wird in der Pharmazie und Medizin unter anderem für die Herstellung der physiologischen Kochsalzlösung, zur Substitution von Natrium- und Chloridionen, bei Atemwegserkrankungen, für Inhalationen und für die Herstellung von Arzneimitteln verwendet.
Salze / HilfsstoffeNatriumchlorid ist die wissenschaftliche Bezeichnung für das Salz im Speisesalz, welches aus Natrium- und Chloridionen im Verhältnis 1:1 besteht. Es wird in der Pharmazie und Medizin unter anderem für die Herstellung der physiologischen Kochsalzlösung, zur Substitution von Natrium- und Chloridionen, bei Atemwegserkrankungen, für Inhalationen und für die Herstellung von Arzneimitteln verwendet.synonym: Natrii chloridum PhEur, Salz, Kochsalz, Speisesalz, NaCl, Natrium chloratum (veraltet)
ProdukteNatriumchlorid ist in Arzneibuchqualität in Apotheken und Drogerien erhältlich. Zu den verfügbaren Medikamenten gehören zum Beispiel Nasensprays, Spüllösungen, Injektions-, Infusions- und Inhalationslösungen. Natriumchloridtabletten werden auch als Schwedentabletten bezeichnet.
Struktur und EigenschaftenDas offizinelle Natriumchlorid (NaCl, Mr = 58.44 g/mol) liegt als weisses, kristallines Pulver, als farblose Kristalle oder weisse Perlen vor. Es ist in Wasser leicht löslich, in Ethanol praktisch unlöslich und hat einen salzigen Geschmack. Das vom Arzneibuch monographierte Natriumchlorid hat eine definierte Qualität und Reinheit.
Die Kristalle wachsen aufgrund der molekularen Kristallstruktur in Kuben. Jedes Ion ist im Kristall von 6 Ionen mit entgegengesetzter Ladung umgeben. Natriumchlorid entsteht bei der Reaktion von elementarem Natrium mit Chlorgas. Es wird jedoch nicht synthetisch hergestellt, sondern zum Beispiel in Salzminen als Steinsalz abgebaut, durch Verdunstung gewonnen oder mithilfe von Bohrungen aus tiefen Gesteinsschichten mit Wasser gelöst. Salz ist im Meerwasser in unvorstellbar grossen Mengen enthalten und ist gleichzeitig auch der Hauptbestandteil des Meersalzes (in der Regel > 95 % oder mehr). Der Schmelzpunkt liegt bei etwa 800 °C.
Struktur: Na+Cl-
Natriumchlorid, zum Vergrössern anklicken. Foto © PharmaWiki
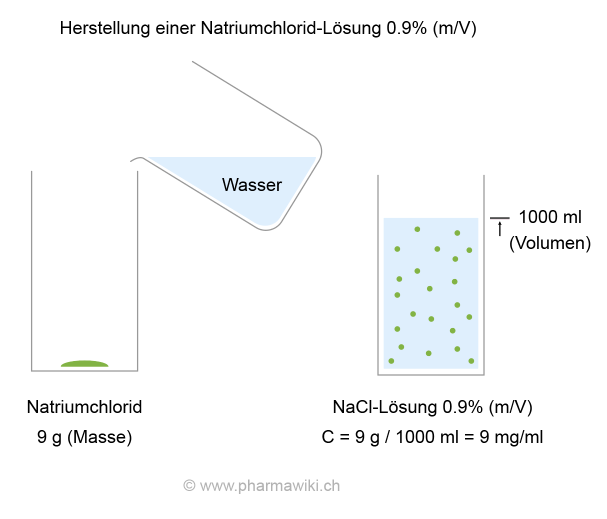
WirkungenEinerseits wird Natriumchlorid für die Herstellung von Arzneimitteln verwendet. Mit dem Salz wird eine sogenannte physiologische und isotonische Lösung hergestellt. Sie enthält 0.9 % Natriumchlorid (m/V). Zubereitet wird sie mit 9 g NaCl, ergänzt auf 1 Liter Wasser für Injektionszwecke. Siehe auch im Artikel → Konzentration.
- Natriumchlorid 9.0 g
- Wasser für Injektionszwecke ad 1000.0 ml
Allerdings ist die Lösung nur annähernd physiologisch, weil bezüglich der Ionenkonzentration, den Bestandteilen als auch bezüglich des pH-Werts relevante Abweichungen bestehen (z.B. Li et al., 2016; Reddi, 2013). Neben der Natriumkonzentration ist vor allem die Chloridkonzentration im Vergleich mit dem Blutserum wesentlich höher. Der pH-Wert liegt bei etwa 5.5 oder noch tiefer. Auch deshalb kann die Zufuhr grosser Mengen zu unerwünschten Wirkungen führen (siehe unten).
Andererseits wird Natriumchlorid auch zur Substitution der Natrium- und Chloridionen verabreicht. Beide Ionen kommen in einer hohen Konzentration vor allem in der extrazellulären Flüssigkeit des Körpers vor. Es sind die zwei wichtigsten Ionen des Blutplasmas. Intrazellulär finden sie sich hingegen in einer wesentlich tieferen Menge, dort dominiert Kalium. Natrium spielt zum Beispiel für die Reizleitung im Nervensystem, für den Blutdruck und den Säure-Base-Haushalt eine wichtige Rolle.
Herstellung einer Natriumchlorid-Lösung 0.9 %, zum Vergrössern anklicken. Illustration © PharmaWiki
AnwendungsgebieteZu den medizinischen und pharmazeutischen Anwendungsgebieten gehören:
- In Form von Nasensprays und Lösungen für die Behandlung von Atemwegserkrankungen, wie z.B. Schnupfen, einer trockenen Nase, einer verstopften Nase und bei Heuschnupfen.
- Für die Wundreinigung.
- Als Trägerlösung für Injektionen, Infusionen und Inhalationen.
- Zum Aufbewahren und Reinigen von Kontaktlinsen.
- In der oralen Rehydratationslösung für die Elektrolyt- und Flüssigkeitszufuhr bei akutem Durchfall oder Erbrechen. Umgekehrt ist Natriumchlorid auch in einigen Abführmitteln für die Behandlung einer Verstopfung in Kombination mit Macrogolen enthalten.
- Als pharmazeutischer Hilfsstoff für verschiedene Darreichungsformen.
- Natriumchlorid-Infusionslösungen können unter anderem als Flüssigkeitsersatz, bei einer Dehydratation, milden Schockzuständen, bei einer Hyponatriämie und bei einer Hypochlorämie eingesetzt werden. Sie sind steril, pyrogenfrei und isoton.
- Schwedentabletten werden bei extremen Sportarten zum Ausgleich des Verlusts durch das starke Schwitzen eingenommen.
- Zur Schleimlösung werden auch hypertone Lösungen verwendet, zum Beispiel bei einer zystischen Fibrose.
- Als Brechmittel bei Vergiftungen (selten).
- Zur akuten Unterdrückung des Würgereizes den befeuchteten Finger in etwas Salz eintauchen und auf die Zunge geben. Zum Beispiel in zahnärztlicher Behandlung.
Die Gegenanzeigen sind vom Arzneimittel und vom Anwendungsgebiet abhängig. Dazu gehören bei der parenteralen Therapie:
- Überempfindlichkeit
- Hypernatriämie
- Hyperchlorämie
- Hypertone Dehydratation
- Hyperhydratation
- Azidose
Die vollständigen Vorsichtsmassnahmen finden sich in der Arzneimittel-Fachinformation.
Unerwünschte WirkungenDie lokal angewandten Lösungen sind in der Regel sehr gut verträglich. Ein Problem stellt die kurze Haltbarkeit von unkonservierten Produkten nach dem Öffnen dar. Deshalb werden Natriumchloridlösungen auch in Einzeldosen angeboten.
Bei der parenteralen Verabreichung können Venenreizungen und eine Thrombophlebitis auftreten. Bei der Verabreichung grosser Mengen kann es zu einer Hyperhydration, Hypernatriämie, Hyperchlorämie, Azidose und Hypokaliämie kommen.
siehe auch- Natrium, Chlor
- Natriumchlorid-Infusionslösung
- Himalayasalz, Schwarzsalz
- Salze, Ionen
- Konzentration
- Nicht zu verwechseln mit → Natriumchlorat
- Traditionelle Konservierungsmethoden
- Arzneimittel-Fachinformation (CH, D)
- B. Braun, Grundlagen der Infusionstherapie, 2012
- Europäisches Arzneibuch PhEur
- Lehr- und Handbücher der Chemie und der pharmazeutischen Technologie
- Lexika der Lebensmitteltechnologie
- Li H. et al. 0.9 % saline is neither normal nor physiological. J Zhejiang Univ Sci B, 2016, 17(3), 181-7 Pubmed

- Reddi B.A. Why is saline so acidic (and does it really matter?). Int J Med Sci, 2013, 10(6), 747-50 Pubmed

Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
Weitere Informationen