Chemische Reaktionen
 PharmaWikiBei einer chemischen Reaktion werden chemische Stoffe zu neuen Verbindungen umgesetzt. Bindungen werden gebrochen und es entstehen neue. Chemische Synthesen sind für jedes Leben auf der Erde, für die Herstellung pharmazeutischer Wirk- und Hilfsstoffe und für unsere moderne Welt essenziell.
PharmaWikiBei einer chemischen Reaktion werden chemische Stoffe zu neuen Verbindungen umgesetzt. Bindungen werden gebrochen und es entstehen neue. Chemische Synthesen sind für jedes Leben auf der Erde, für die Herstellung pharmazeutischer Wirk- und Hilfsstoffe und für unsere moderne Welt essenziell.synonym: Reaktionen, Chemical Reactions, Chemische Synthesen
DefinitionBei einer chemischen Reaktion werden chemische Stoffe zu neuen Verbindungen umgesetzt. Bindungen zwischen den Atomen werden gespalten und es entstehen neue.
Die Ausgangssubstanzen werden als Reaktanten (oder Edukte, bei Enzymen Substrate) und die entstehenden Stoffe als Produkte bezeichnet.
Ein einfaches Beispiel einer chemischen Reaktion ist die Synthese von Wasser aus Wasserstoff und Sauerstoff (Knallgasreaktion):
- 2 H2 (Wasserstoff) + O2 (Sauerstoff) → 2 H2O (Wasser)
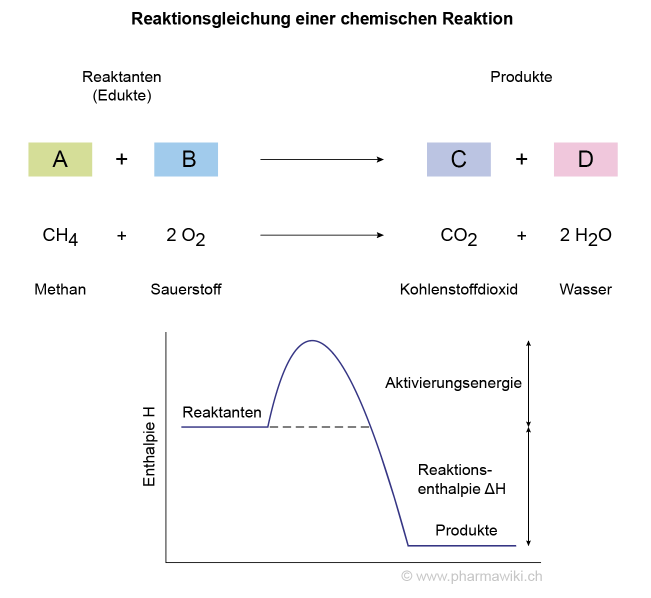
Oder die Verbrennung von Methan:
- CH4 (Methan) + 2 O2 (Sauerstoff) → CO2 (Kohlenstoffdioxid) + 2 H2O (Wasser)
Die Produkte unterscheiden sich in ihren chemischen und physikalischen Eigenschaften von den Ausgangsstoffen. Das bekannteste Beispiel in diesem Zusammenhang ist die Synthese des essbaren Geschmacksverstärkers Kochsalz (Natriumchlorid) aus dem brennbaren und reaktionsfreudigen Metall Natrium und dem toxischen Gas Chlor.
Chemische Reaktionen, zum Vergrössern anklicken. Illustration © PharmaWiki
NomenklaturZur Darstellung chemischer Reaktionen werden die Reaktanten links von einem Reaktionspfeil und die Produkte rechts dargestellt (Reaktionsgleichung).
Über dem Pfeil können die Bedingungen angegeben werden, zum Beispiel Wärme (Δ) oder Katalysatoren.
Weil die Atome während der Reaktion weder entstehen noch zerstört werden, bleibt ihre Anzahl vorher und nachher gleich. Die Verhältnisse sollen mit Koeffizienten vor den Verbindungen richtig angegeben werden. Auch die Masse ist vor und nach der Reaktion dieselbe.
In Klammern kann hinter den Verbindungen der Aggregatzustand angegeben werden:
- (g) für gasförmig, gas
- (l) für flüssig, liquid
- (s) für fest, solid
(aq) steht für aqueous (wässrig) und Δ für Wärme oder Hitze.
ReaktionstypenIm Folgenden sind Beispiele chemischer Reaktionen der anorganischen und organischen Chemie aufgelistet:
- Redox-Reaktionen (Oxidation und Reduktion): Übertragung von Elektronen, z.B. eine Verbrennung
- Säure-Base-Reaktionen: Reaktion von Säuren mit Basen (auch Neutralisationsreaktionen)
- Additionsreaktionen: Aus zwei Verbindungen entsteht eine neue.
- Eliminationsreaktionen: Eine kleinere Verbindung verlässt eine grössere.
- Fällungsreaktionen: Ausfällung aus einer Flüssigkeit
- Substitutionsreaktionen: Ersatz einer funktionellen Gruppe durch eine andere.
- Hydrolyse: Aufspaltung mit Wasser
- Zerfallsreaktionen
- Maillard-Reaktion: führt zur Bräunung von Lebensmitteln, z.B. Grillgut, Pommes frites
Für einige chemische Reaktionen wird Energie benötigt, zum Beispiel in Form von Wärme aus der Umgebung. Diese Reaktionen werden als endotherm bezeichnet.
Bei exothermen Reaktionen wird umgekehrt Energie frei, so zum Beispiel bei einer Verbrennung.
Die Aktivierungsenergie ist diejenige Energie, welche zur Einleitung der Reaktion erforderlich ist. So brennt beispielsweise Holz nicht spontan, es muss zuerst entzündet werden.
Als Mass für die Energie einer Reaktion wird die Reaktionsenthalpie ΔH verwendet:
ΔH = H (Produkte) - H (Reaktante)
Bei einer exothermen Reaktion ist ΔH negativ, bei einer endothermen Reaktion positiv. Die Einheit der Energie ist Joule (J). In der Chemie wird auch J/mol verwendet.
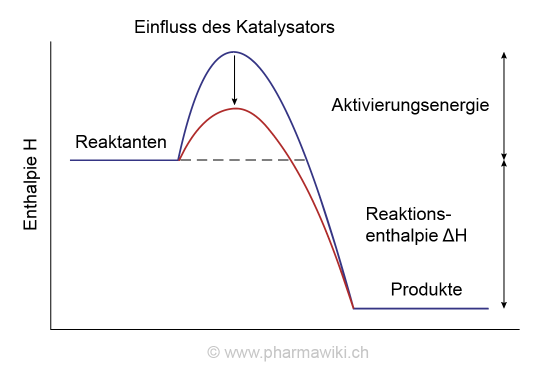
KatalysatorenKatalysatoren und Biokatalysatoren wie die Enzyme erleichtern eine chemische Reaktion, indem sie die Aktivierungsenergie reduzieren.
Auch eine hohe Temperatur beschleunigt chemische Reaktionen, weil sich die Teilchen schneller bewegen und sich die Wahrscheinlichkeit für eine Reaktion dadurch erhöht.
Einfluss von Katalysatoren auf die Aktivierungsenergie, zum Vergrössern anklicken. Illustration © PharmaWiki
ReaktionsgleichgewichtReversible chemische Reaktionen können in beide Richtungen verlaufen. Ein Produkt kann also wieder zurück zu seinen Reaktanten reagieren. Das sogenannte Reaktionsgleichgewicht kann links (bei den Reaktanten) oder rechts (bei den Produkten) liegen. Reaktionen laufen solange ab, bis sie beendet sind oder bis das Gleichgewicht erreicht ist.
BedeutungChemische Reaktionen laufen im menschlichen Körper in jeder Sekunde in einer unvorstellbar grossen Anzahl ab und sie sind für jedes Leben auf der Erde essenziell. Das Leben ist aus chemischen Reaktionen und durch physikalische Phänomen auf der frühen Erde hervorgegangen, als erstmals selbstvermehrende Moleküle entstanden sind. Die grösste Chemikerin ist die Natur.
In der Pharmazie sind Reaktionen insbesondere für die Synthese pharmazeutischer Wirkstoffe und Hilfsstoffe zentral. Des Weiteren ist auch unsere zivilisierte Welt ohne sie undenkbar.
MissbrauchChemische Synthesen werden unter anderem für die illegale Herstellung von Rauschmitteln, Giften und chemischen Waffen (C-Waffen) missbraucht.
siehe auchChemische Elemente, Moleküle, Salze, Redox-Reaktionen, Verbrennungen Chemie, Chemische Experimente, Katalysatoren
Literatur- Fachliteratur
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.