Ammoniak
 Hilfsstoffe
Hilfsstoffe  BasenAmmoniak (NH3) ist ein farbloses Gas mit einem typischen und stechenden Geruch, das aus Stickstoff und Wasserstoff gewonnen werden kann. Es ist mit Wasser mischbar und wird häufig in Form wässriger Lösungen verwendet. Medizinisch werden das Gas und seine Lösungen heute selten verwendet. Sie spielen aber eine wichtige Rolle bei der Herstellung von Ammoniumsalzen, für chemische Synthesen und als Reinigungsmittel. Bei der Abgabe muss beachtet werden, dass Ammoniak-Lösungen für verschiedene Zwecke missbraucht werden können.
BasenAmmoniak (NH3) ist ein farbloses Gas mit einem typischen und stechenden Geruch, das aus Stickstoff und Wasserstoff gewonnen werden kann. Es ist mit Wasser mischbar und wird häufig in Form wässriger Lösungen verwendet. Medizinisch werden das Gas und seine Lösungen heute selten verwendet. Sie spielen aber eine wichtige Rolle bei der Herstellung von Ammoniumsalzen, für chemische Synthesen und als Reinigungsmittel. Bei der Abgabe muss beachtet werden, dass Ammoniak-Lösungen für verschiedene Zwecke missbraucht werden können. synonym: Ammonia, Ammoniae solutio
ProdukteAmmoniak-Lösungen sind im Fachhandel (z.B. Apotheken, Drogerien) in verschiedenen Konzentrationen erhältlich. Sie werden auch als Salmiak oder Salmiakgeist bezeichnet.
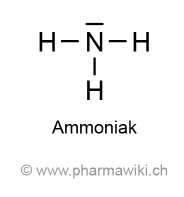
Struktur und EigenschaftenAmmoniak (NH3) ist ein farbloses Gas mit einem typischen, stechenden und unangenehmen Geruch, das aus Stickstoff (N2) und Wasserstoff (H2) gewonnen werden kann. Im Labor kann er mit einem Ammoniumsalz und Natriumhydroxid hergestellt werden:
- NH4+ (Ammoniumion) + OH- (Hydroxid) → NH3 (Ammoniak) + H2O (Wasser)
Ammoniak ist mit Wasser mischbar. Die konzentrierte Ammoniak-Lösung enthält zwischen 25 % und 30 % Ammoniak. Sie liegt als klare, farblose und stark ätzende Flüssigkeit mit einem pH-Wert von 13 vor und ist mit Wasser mischbar. Aufbewahrt werden soll sie bei höchstens 20 °C und nicht zusammen mit Säuren. In der Pharmacopoea Helvetica ist zusätzlich die Ammoniak-Lösung 10 % PH monographiert. Die Amine sind formale vom Ammoniak abgeleitet.
Ammoniak, zum Vergrössern anklicken. Illustration © PharmaWiki
WirkungenAmmoniak ist basisch. Er reagiert beispielsweise mit Säuren, wobei die Ammoniumsalze entstehen, so zum Beispiel Ammoniumchlorid bei der Reaktion mit Salzsäure:
- NH3 (Ammoniak) + HCl (Salzsäure) → NH4Cl (Ammoniumchlorid)
Zusammen mit Salptersäure entsteht Ammoniumnitrat (NH4NO3). NH4+ wird als Ammoniumion bezeichnet.
AnwendungsgebieteAmmoniak und seine Lösungen werden heute selten medizinisch eingesetzt. Die Zubereitungen wurden in der Vergangenheit unter anderem für die lokale Behandlung von Insektenstichen, als Einreibemittel und als Riechmittel bei Ohnmacht verwendet.
Ammoniak wird für chemische Synthesen, als Reagens, Lösungsmittel und in der Pharmazie für die Herstellung von Wirkstoffsalzen wie beispielsweise Ammoniumchlorid oder Ammoniumbituminosulfonat verwendet.
Verdünnte Lösungen werden oft als Reinigungsmittel eingesetzt, zum Beispiel für Glas, Porzellan oder Metalle.
MissbrauchAmmoniak kann für die Herstellung der Kokainbase (Freebase) verwendet werden. Dabei handelt es sich um die deprotonierte und rauchbare Form von Kokain. Ammoniak wird als Chemikalie auch für die illegale Herstellung von Rauschmitteln wie Methamphetamin missbraucht.
An der Fussball-Weltmeisterschaft 2018 inhalierten einige russische Spieler kurz vor ihrem Einsatz Ammoniak als leistungsförderndes Mittel.
Gibt man Ammoniak-Lösung zu elementaren Iodkristallen, entsteht der labile und hochexplosive Iodstickstoff (NI3). Trockener Iodstickstoff explodiert bereits bei einer leichten Berührung mit einem lauten Knall, was zu Schädigungen des Gehörs und zu Verletzungen führen kann.
Unerwünschte WirkungenDie konzentrierte Lösung kann schwere Verätzungen der Haut und der Augen verursachen und die Atemwege reizen. Deshalb sollen bei der Handhabung die Vorsichtsmassnahmen im Sicherheitsdatenblatt genau beachtet werden. Bei der Arbeit mit der konzentrierten Lösung sollen Schutzhandschuhe, Schutzkleidung, ein Augenschutz und ein Gesichtsschutz getragen werden. Die Arbeit soll unter dem Abzug durchgeführt werden.
siehe auchLiteratur- Arzneimittel-Fachinformation (CH)
- Europäisches Arzneibuch PhEur
- Lehrbücher der Chemie
- Pharmacopoea Helvetica
- Sicherheitsdatenblatt
- Weitere Quellen
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.