Schwefeldioxid
 Hilfssstoffe
Hilfssstoffe  Konservierungsmittel Schwefeldioxid (SO2) ist ein farbloses Gas mit einem stechenden Geruch, das bei der Verbrennung von Schwefel entsteht. Es wird in der Natur zum Beispiel aus Vulkanen freigesetzt. Schwefeldioxid hat antimikrobielle und konservierende Eigenschaften und wird unter anderem für die Synthese der Schwefelsäure, als Konservierungsmittel für Lebensmittel und für chemische Synthesen verwendet. Schwefeldioxid ist stark toxisch und entzündungserregend. Es wird auch bei der Verbrennung fossiler Brennstoffe in die Luft abgegeben, weil diese relativ hohe Schwefelanteile enthalten. Der weltweite Schiffsverkehr ist für einen hohen Anteil der Emissionen verantwortlich.
Konservierungsmittel Schwefeldioxid (SO2) ist ein farbloses Gas mit einem stechenden Geruch, das bei der Verbrennung von Schwefel entsteht. Es wird in der Natur zum Beispiel aus Vulkanen freigesetzt. Schwefeldioxid hat antimikrobielle und konservierende Eigenschaften und wird unter anderem für die Synthese der Schwefelsäure, als Konservierungsmittel für Lebensmittel und für chemische Synthesen verwendet. Schwefeldioxid ist stark toxisch und entzündungserregend. Es wird auch bei der Verbrennung fossiler Brennstoffe in die Luft abgegeben, weil diese relativ hohe Schwefelanteile enthalten. Der weltweite Schiffsverkehr ist für einen hohen Anteil der Emissionen verantwortlich.synonym: SO2, E 220, Sulfur dioxide, Sulphur dioxide
ProdukteSchwefeldioxid ist als verflüssigtes Gas in Druckgasflaschen im Handel.
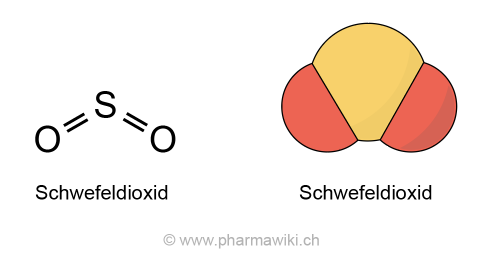
Struktur und EigenschaftenSchwefeldioxid (SO2, 64.1 g/mol) liegt als farbloses Gas mit einem charakteristischen, stechenden und reizenden Schwefelgeruch vor, das in Wasser löslich ist. Der Siedepunkt liegt bei -10 °C. Schwefeldioxid ist nicht brennbar und ist schwerer als Luft. Es entsteht bei der Verbrennung von Schwefel. Diese Reaktion verläuft exotherm:
- S8 (Schwefel) + 16 O2 (Sauerstoff) → 8 SO2 (Schwefeldioxid)
Schwefeldioxid kommt natürlich zum Beispiel in Vulkangasen und in einer geringen Konzentration in der Erdatmosphäre vor. Er entsteht auch bei der Verbrennung von Schwefelwasserstoff.
Schwefeldioxid wird für die Synthese der Schwefelsäure verwendet:
- 2 SO2 (Schwefeldioxid) + 2 H2O (Wasser) + O2 (Sauerstoff) → 2 H2SO4 (Schwefelsäure)
Mit Wasser entsteht die extrem instabile schweflige Säure, die im Wasser jedoch nicht nachweisbar ist:
- SO2 (Schwefeldioxid) + H2O (Wasser) → H2SO3 (Schweflige Säure)
Schwefeldioxid. Der Winkel zwischen den Sauerstoffatomen beträgt 119 Grad. Zum Vergrössern anklicken. Illustration © PharmaWiki.
WirkungenSchwefeldioxid hat antiseptische, antimikrobielle, insektizide, konservierende, bleichende (entfärbende) und antioxidative Eigenschaften. Auch für viele Pflanzen und für Tiere ist es in höheren Konzentrationen schädlich.
Schwefeldioxid wird im menschlichen Körper zum Beispiel aus der Aminosäure Cystein gebildet und nimmt physiologische Funktionen wahr.
AnwendungsgebieteZu den Anwendungsgebieten gehören (Auswahl):
- Für die Synthese der Schwefelsäure.
- Als Konservierungsmittel zum Schwefeln von Lebensmitteln, zum Beispiel für Früchte, Trockenfrüchte und für Wein (siehe auch unter → Sulfite).
- Als Lösungsmittel und für chemische Synthesen.
- Früher als Desinfektionsmittel (Schwefel-Räucherungen).
- Als Bleichmittel.
Schwefeldioxid ist beim Einatmen giftig und stark entzündungserregend. Es verursacht schwere Verätzungen der Haut, kann die Atemwege reizen und verursacht schwere Augenschäden. Die entsprechenden Vorsichtsmassnahmen im Sicherheitsdatenblatt müssen beachtet werden.
Schwefeldioxid wird bei der Verbrennung fossiler Brennstoffe wie Erdöl freigesetzt, weil darin Schwefel in einer relativ hohen Konzentration enthalten ist. Problematisch ist dies vor allem, wenn der Schwefel vor der Verbrennung nicht entfernt wird. Für einen hohen Beitrag der Emissionen ist der weltweite Schiffsverkehr verantwortlich, darunter auch die Kreuzfahrtschiffe.
Schwefeldioxid kann die Entstehung von Atemwegserkrankungen fördern und einen negativen Einfluss auf den Krankheitsverlauf haben.
siehe auchSchwefel, Schwefelsäure, Schweflige Säure, Verbrennungen Chemie, Sulfite, Erdöl, Wein
Literatur- EFSA
- Fachliteratur
- Huang Y. et al. Endogenous Sulfur Dioxide: A New Member of Gasotransmitter Family in the Cardiovascular System. Oxid Med Cell Longev, 2016, 2016, 8961951 Pubmed

- Kochi T. et al. Influence of sulfur dioxide on the respiratory system of Miyakejima adult residents 6 years after returning to the island. J Occup Health, 2017, 59(4), 313-326 Pubmed

- Lehrbücher der Chemie
- Lexika der Lebensmitteltechnologie
- Lexika der Pharmazie
- Lungenliga Schweiz
- Sicherheitsdatenblatt (CH)
- Wang X.B. et al. Sulfur dioxide: foe or friend for life? Histol Histopathol, 2017, 32(12), 1231-1238 Pubmed

- Wang X.B., Du J.B., Cui H. Sulfur dioxide, a double-faced molecule in mammals. Life Sci, 2014, 98(2), 63-7 Pubmed

Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
PharmaWiki mit Google durchsuchen.