Redox-Reaktionen
 Chemische ReaktionenEine Redox-Reaktion ist eine chemische Reaktion, bei welcher Elektronen übertragen werden. Redox steht für Reduktion und Oxidation. Redox-Reaktionen haben für das Leben eine fundamentale Bedeutung, zum Beispiel für die Energiegewinnung, den Metabolismus und die Photosynthese. Sie kommen auch bei der Synthese pharmazeutischer Wirkstoffe und Hilfsstoffe zur Anwendung.
Chemische ReaktionenEine Redox-Reaktion ist eine chemische Reaktion, bei welcher Elektronen übertragen werden. Redox steht für Reduktion und Oxidation. Redox-Reaktionen haben für das Leben eine fundamentale Bedeutung, zum Beispiel für die Energiegewinnung, den Metabolismus und die Photosynthese. Sie kommen auch bei der Synthese pharmazeutischer Wirkstoffe und Hilfsstoffe zur Anwendung.synonym: Reduktion, Oxidation, Reduktions-Oxidations-Reaktion
DefinitionEine Redox-Reaktion (Reduktions-Oxidations-Reaktion) ist eine chemische Reaktion, bei welcher Elektronen übertragen werden und bei der sich die Oxidationszahl der chemischen Elemente verändert.
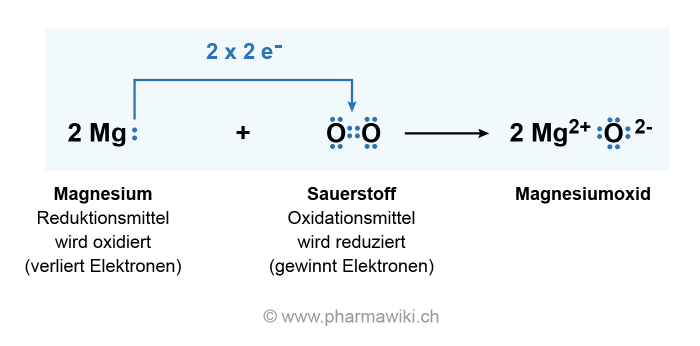
Ein Beispiel ist die Oxidation von elementarem Magnesium mit Sauerstoff:
- 2 Mg (Magnesium elementar) + O2 (Sauerstoff) → 2 MgO (Magnesiumoxid)
Dabei wird Magnesium als Reduktionsmittel bezeichnet. Es gibt zwei Elektronen ab.
Sauerstoff ist ein Oxidationsmittel, das zwei Elektronen aufnimmt.
- O (Sauerstoff) + 2 e- (Elektron) → O2- (Oxid)
Magnesium, das Reduktionsmittel, wird oxidiert und Sauerstoff, das Oxidationsmittel, wird reduziert.
Redox-Reaktion mit Magnesium und Sauerstoff. Illustration © PharmaWiki
MerkhilfeIm Englischen gibt es die folgende Merkhilfe: OIL RIG.
- OIL: Oxidation Is Loss of eletrons
- RIG: Reduction Is Gain of electrons
Man kann sich auch merken, dass das Nichtmetall Sauerstoff das wichtigste Oxidationsmittel ist und Metalle gerne Elektronen abgeben. Daraus lassen sich viele Reaktionen ableiten.
Weitere BeispieleAuch beim Verrosten von Eisen findet eine Redox-Reaktion statt:
- 4 Fe (Eisen elementar) + 3 O2 (Sauerstoff) → 2 Fe2O3 (Eisenoxid)
Redox-Reaktionen führen mit Metallen also häufig zur Bildung von Salzen (ionischen Verbindungen).
Verbrennungen sind Oxidationen, zum Beispiel die Verbrennung von Methan (aus Erdgas):
- CH4 (Methan) + 2 O2 (Sauerstoff) → CO2 (Kohlenstoffdioxid) + 2 H2O (Wasser)
Bildung von Zinkoxid:
- 2 Zn (Zink) + O2 (Sauerstoff) → 2 ZnO (Zinkoxid)
Die Beteiligung von Sauerstoff ist keine Bedingung für eine Redox-Reaktion. Hier wird Kupfer reduziert und Eisen oxidiert:
- CuSO4 (Kupfersulfat) + Fe (Eisen elementar) → FeSO4 (Eisensulfat) + Cu (Kupfer elementar)
Reaktion von Calcium mit Chlorgas:
- Ca (Calcium elementar) + Cl2 (Chlorgas) → CaCl2 (Calciumchlorid)
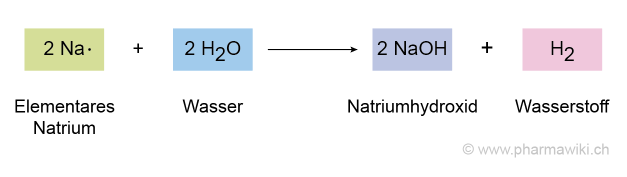
Die heftige Reaktion von Natrium mit Wasser, zum Vergrössern anklicken. Illustration © PharmaWiki
OxidationszahlJedem Atom oder Ion kann eine Oxidationszahl (= Oxidationsstufe) zugeordnet werden. Der entsprechende Wert kann 0, negativ oder positiv sein.
- Bei der Oxidation steigt die Oxidationszahl.
- Bei der Reduktion sinkt die Oxidationszahl.
Wird Magnesium (Mg) zum Magnesiumion oxidiert, steigt die Oxidationszahl von 0 auf +2. Dies entspricht der Ladung des Ions (Mg2+). Die Oxidationszahl des Sauerstoffs sinkt bei dieser Reaktion von 0 auf -2 (Oxid: O-2). Für die detaillierten Regeln zur Zuordnung der Oxidationszahl verweisen wir auf die Fachliteratur.
ElektrolyseAuch bei der → Elektrolyse finden an beiden Elektroden Redox-Reaktionen statt (siehe dort).
siehe auchChemische Reaktionen, Elektrischer Strom, Antioxidanzien
Literatur- Fachliteratur
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
PharmaWiki mit Google durchsuchen.