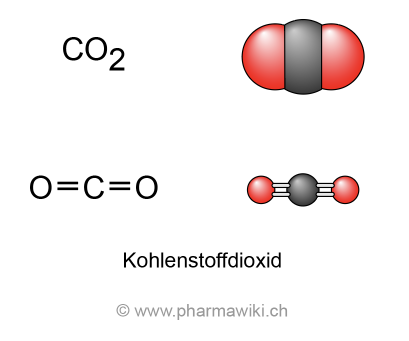
Kohlenstoffdioxid
 GaseKohlenstoffdioxid (CO2) ist ein farbloses, nicht brennbares und in tiefen Konzentrationen geruchloses Gas. Es ist ein natürlicher Bestandteil der Luft und der Erdatmosphäre. Kohlenstoffdioxid entsteht zum Beispiel bei Verbrennungen und bei der Energiegewinnung im menschlichen Körper. Es wird von Pflanzen als Substrat für die Photosynthese verwendet. In der Pharmazie und Medizin wird es unter anderem als medizinisches Gas, als Abführmittel, nach einem Atemstillstand, als Hilfsstoff und für chemische Synthesen eingesetzt. Die unkontrollierte Freisetzung von Kohlenstoffdioxid in die Atmosphäre führt aufgrund des Treibhauseffekts zu einer globalen Erwärmung, die in der Zukunft voraussichtlich dramatische Auswirkungen haben wird.
GaseKohlenstoffdioxid (CO2) ist ein farbloses, nicht brennbares und in tiefen Konzentrationen geruchloses Gas. Es ist ein natürlicher Bestandteil der Luft und der Erdatmosphäre. Kohlenstoffdioxid entsteht zum Beispiel bei Verbrennungen und bei der Energiegewinnung im menschlichen Körper. Es wird von Pflanzen als Substrat für die Photosynthese verwendet. In der Pharmazie und Medizin wird es unter anderem als medizinisches Gas, als Abführmittel, nach einem Atemstillstand, als Hilfsstoff und für chemische Synthesen eingesetzt. Die unkontrollierte Freisetzung von Kohlenstoffdioxid in die Atmosphäre führt aufgrund des Treibhauseffekts zu einer globalen Erwärmung, die in der Zukunft voraussichtlich dramatische Auswirkungen haben wird.synonym: CO2, Kohlendioxid, Carbonei dioxidum PhEur, Carbon dioxide, E 290
ProdukteKohlenstoffdioxid ist unter anderem in Druckgasflaschen verflüssigt und als Trockeneis im Handel. Die verschiedenen Produkte unterscheiden sich in ihrer Reinheit. Kohlenstoffdioxid ist auch im Arzneibuch monographiert. Es ist zum Beispiel in Lebensmittelgeschäften für die Eigenherstellung von Sprudelwasser verfügbar.
StrukturKohlenstoffdioxid (CO2, O=C=O, Mr = 44.01 g/mol) liegt als farbloses, nicht brennbares und bei tiefen Konzentrationen geruchloses Gas vor, das in Wasser etwas löslich ist. Es ist ein lineares Molekül, das aus einem Kohlenstoffatom besteht, das kovalent mit zwei Sauerstoffatomen verbunden ist. Unter Druck verflüssigt sich das Gas. Festes Kohlenstoffdioxid wird als Trockeneis bezeichnet. Es sublimiert bei -78.5 °C, d.h. es geht direkt aus dem festen in den gasförmigen Zustand über. Kohlenstoffdioxid ist ein natürliches Gas, das zum Kohlenstoffzyklus gehört. Seit dem Beginn der industriellen Revolution ist die CO2-Konzentration in der Atmosphäre stark, um mehr als einen Drittel, auf heute über 412 ppm angestiegen (Quelle: NASA).
Eigenschaften und ReaktionenBei der Reaktion von Säuren mit Carbonaten wie Calciumcarbonat entsteht Kohlenstoffdioxid:
- 2 HCl (Salzsäure) + CaCO3 (Calciumcarbonat, Kalk) → CO2 (Kohlenstoffdioxid) + CaCl2 (Calciumchlorid) + H2O (Wasser)
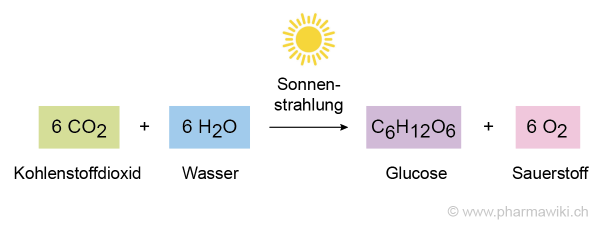
Kohlensäure wird von Pflanzen bei der Photosynthese für die Synthese von Kohlenhydraten als Substrat benötigt:
- 6 CO2 (Kohlenstoffdioxid) + 6 H2O (Wasser) → C6H12O6 (Glucose) + O2 (Sauerstoff)
Umgekehrt verbrauchen Menschen den dabei freigesetzten Sauerstoff für die Energiegewinnung aus Kohlenhydraten:
- C6H12O6 (Glucose) + 6 O2 (Sauerstoff) → 6 CO2 (Kohlenstoffdioxid) + 6 H2O (Wasser)
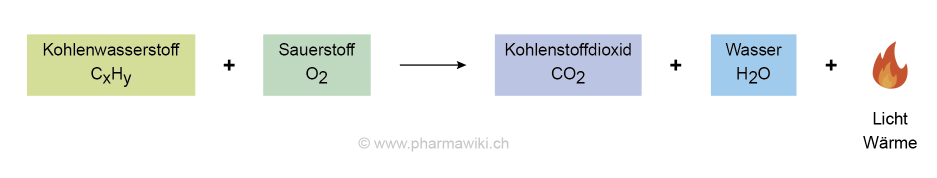
Bei der Verbrennung von organischen Verbindungen und der Gewinnung von Wärme und Energie wird Kohlenstoffdioxid freigesetzt (z.B. Holz, Kohle, Erdgas, Kerosin, Benzin, Diesel, Öl). Am Beispiel Methan, dem wichtigsten Bestandteil des Erdgases:
- CH4 (Methan) + 2 O2 (Sauerstoff) → CO2 (Kohlenstoffdioxid) + 2 H2O (Wasser)
Bei der alkoholischen Gärung (Fermentation) wird von Hefepilzen Ethanol und Kohlenstoffdioxid gebildet. Dies spielt zum Beispiel bei der Bierherstellung oder beim Aufgehen von Broten eine wichtige Rolle. Organisches Material wird von Pilzen abgebaut und steht für den Kohlenstoffzyklus wieder zur Verfügung:
Bei der Erwärmung kann aus Carbonaten und Hydrogencarbonaten Kohlenstoffdioxid freigesetzt werden:
- CaCO3 (Calciumcarbonat) → CaO (Calciumoxid) + CO2 (Kohlenstoffdioxid)
Die Kohlensäure entsteht, wenn Kohlenstoffdioxid (CO2) in Wasser gelöst wird. Dabei bildet sich das folgende Gleichgewicht:
- CO2 (Kohlenstoffdioxid) + H2O (Wasser) ⇌ H2CO3 (Kohlensäure)
Die Reaktion führt aufgrund der Deprotonierung zu einer leichten Ansäuerung des Wassers:
- H2CO3 (Kohlensäure) ⇌ HCO3- (Hydrogencarbonat) + H+ ⇌ CO32- (Carbonat) + H+
Mit Calciumhydroxid kann Kohlenstoffdioxid gebunden werden:
- Ca(OH)2 (Calciumhydroxid) + CO2 (Kohlenstoffdioxid) → CaCO3 (Calciumcarbonat) + H2O (Wasser)
Photosynthese, zum Vergrössern anklicken. Illustration © PharmaWiki
Anwendungsgebiete (Auswahl)- Medizinisch in Kombination mit Sauerstoff zur Stimulation der Atmung nach einem Atemstillstand (z.B. Carbogen®).
- Als Abführmittel in Form von Suppositorien (z.B. Lecicarbon®, Bildung aus Natriumhydrogencarbonat).
- Aus verschiedenen Antazida wird Kohlenstoffdioxid freigesetzt.
- Bei der Auflösung von Brausetabletten und Brausepulvern.
- Funktionsprinzip von Backtriebmitteln.
- Für chemische Synthesen, als Lösungsmittel und Extraktionsmittel.
- Für die Herstellung von Sprudelwasser, als Säureregulator, als Treibgas, Schutzgas und Kühlmittel in der Lebensmitteltechnologie.
- Carbonate und Hydrogencarbonate spielen in der Pharmazie eine wichtige Rolle als Wirk- und vor allem als Hilfsstoffe (z.B. Calciumcarbonat, Natriumcarbonat, Kaliumcarbonat und Natriumhydrogencarbonat.
Verbrennung von Holz, zum Vergrössern anklicken. Foto © PharmaWiki
Unerwünschte WirkungenHohe Kohlenstoffdioxidkonzentrationen führen beim Menschen zur Erstickung, weil der Sauerstoff verdrängt wird. Der Kontakt mit dem verflüssigten Gas verursacht Erfrierungen. Die Druckbehälter können bei einer Erwärmung explodieren.
Kohlenstoffdioxid ist das wichtigste Treibhausgas. Die globale Erwärmung ist eine Folge der unkontrollierten Freisetzung des Gases in die Atmosphäre. Die wichtigsten Ursachen sind die Verbrennung fossiler Brennstoffe mit Kohlenwasserstoffen (Erdöl, Kohle, Erdgas), industrielle Prozesse und die weltweite Abholzung und Waldrodung. Die ungebremste Klimaerwärmung wird in der Zukunft voraussichtlich zu dramatischen Veränderungen auf der Erde führen.
Das übermässig produzierte Kohlenstoffdioxid löst sich zudem im Wasser der Ozeane, was aufgrund der Bildung der Kohlensäure und ihrer Dissoziation zu einer Ansäuerung führt, wodurch das marine Leben bedroht wird.
Verbrennung eines Kohlenwasserstoffs, zum Vergrössern anklicken. Illustration © PharmaWiki
siehe auchKohlensäure, Medizinische Gase, Erdöl, Kohle, Erdgas, Kohlenstoffmonoxid, Kohlenwasserstoffe, Blut, eis
Literatur- Arzneimittel-Fachinformation (CH)
- Fachliteratur
- FAO
- Lehrbücher der Chemie
- Lexia der Lebensmitteltechnologie
- NASA https://climate.nasa.gov

- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
Weitere InformationenPharmaWiki mit Google durchsuchen.