Thiole
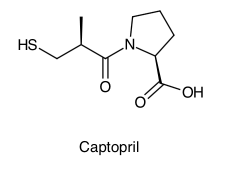
 StoffgruppenThiole sind Schwefelanaloge der Alkohole mit der allgemeinen chemischen Struktur R-SH. Im Unterschied zu den Alkoholen bilden sie kaum Wasserstoffbrücken aus und haben deshalb einen tieferen Siedepunkt. Die niedermolekularen Vertreter sind flüchtig und haben einen unangenehmen Geruch. Thiole sind stärkere Säuren als Alkohole und können mit Basen Salze bilden. Einige Wirkstoffe sind Thiole, zum Beispiel der ACE-Hemmer Captopril.
StoffgruppenThiole sind Schwefelanaloge der Alkohole mit der allgemeinen chemischen Struktur R-SH. Im Unterschied zu den Alkoholen bilden sie kaum Wasserstoffbrücken aus und haben deshalb einen tieferen Siedepunkt. Die niedermolekularen Vertreter sind flüchtig und haben einen unangenehmen Geruch. Thiole sind stärkere Säuren als Alkohole und können mit Basen Salze bilden. Einige Wirkstoffe sind Thiole, zum Beispiel der ACE-Hemmer Captopril.synonym: Mercaptane, R-SH
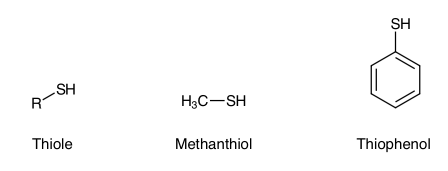
DefinitionThiole sind organische Verbindungen mit der allgemeinen Struktur R-SH. Es sind Schwefel-Analoge der Alkohole (R-OH). R kann aliphatisch oder aromatisch sein. Der einfachste aliphatische Vertreter ist Methanthiol, der einfachste aromatische ist Thiophenol (Analogon von Phenol).
Thiole sind formal von Schwefelwasserstoff (H2S) abgeleitet, bei welchem ein Wasserstoffatom durch einen Rest ersetzt wurde.
NomenklaturDie Bezeichnungen der Verbindungen werden mit dem Suffix -thiol gebildet. Für einige Moleküle und Wirkstoffe ist auch das veraltete Suffix oder Präfix Mercaptan geläufig. Die -SH-Gruppe wird als Sulfhydrylgruppe bezeichnet.
Der Name Thiol ist von Schwefel abgeleitet.
VertreterBeispiele:
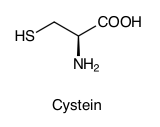
- Cystein (Aminosäure)
- Ethanthiol
- Methanthiol
- Thiophenol
- Niedermolekulare Thiole haben häufig einen unangenehmen Geruch, zum Beispiel nach faulen Eiern und Verwesung.
- Stinktiere bilden Thiole.
- Aufgrund des kleinen Unterschieds in der Elektronegativität von Schwefel und Wasserstoff sind Thiole kaum polar und bilden kaum Wasserstoffbrücken aus. Deshalb sind die Siedepunkte tiefer als bei vergleichbaren Alkoholen. Thiole sind flüchtig (Geruch).
- Aus demselben Grund sind die Thiole weniger gut wasserlöslich.
Thiole sind stärkere Säuren als Alkohole. Ihr pKa liegt etwa bei 8 bis 10:
- CH3-SH (Methanthiol) + NaOH (Natriumhydroxid) → CH3-Na+ (Methanthiolat) + H2O (Wasser)
Wie die Alkohole können die Thiole Ester bilden, die sogenannten Thioester. Ether mit einem Schwefelatom werden als Thioether und organische Sulfide bezeichnet (Suffix: -sulfid).
Thiole können zu Disulfiden oxidiert werden:
- R1-SH + R2-SH → R1-S-S-R2
Proteine wie beispielsweise Insulin und seine Derivate können Disulfidbrücken zwischen Cysteinen enthalten.
In der PharmazieEinige pharmazeutische Wirkstoffe sind Thiole, zum Beispiel der ACE-Hemmer Captopril oder Mercaptamin.
- Arzneimittel-Fachinformation
- Fachliteratur
- IUPAC
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
