Verbrennungen (Chemie)
 Chemische ReaktionenBei einer Verbrennung reagiert ein Brennstoff wie beispielsweise Holz, Benzin oder Ethanol mit Sauerstoff oder einem anderen Oxidationsmittel. Es handelt sich um eine exotherme chemische Reaktion, bei welcher Wärme, Licht und Feuer freigesetzt werden kann. Verbrennungen können auch langsam und unbemerkt verlaufen, wie zum Beispiel das Rosten von Eisen. Viele Verbrennungsprodukte sind für den Menschen gesundheitsschädlich und können Atemwegs- und Krebserkrankungen verursachen.
Chemische ReaktionenBei einer Verbrennung reagiert ein Brennstoff wie beispielsweise Holz, Benzin oder Ethanol mit Sauerstoff oder einem anderen Oxidationsmittel. Es handelt sich um eine exotherme chemische Reaktion, bei welcher Wärme, Licht und Feuer freigesetzt werden kann. Verbrennungen können auch langsam und unbemerkt verlaufen, wie zum Beispiel das Rosten von Eisen. Viele Verbrennungsprodukte sind für den Menschen gesundheitsschädlich und können Atemwegs- und Krebserkrankungen verursachen. synonym: Combustion
Hinweis zu diesem ArtikelDieser Artikel bezieht sich auf Verbrennungen in der Chemie. Siehe auch unter → Verbrennungen (Medizin).
Verbrennung von Holz, zum Vergrössern anklicken. Fotos © PharmaWiki
VerbrennungenMit einer Verbrennung ist in der Chemie in der Regel eine Oxidation gemeint, bei welcher Energie in Form von Wärme, Licht und Feuer freigesetzt wird. Die chemische Energie der Materie wird in die anderen Energieformen (z.B. Wärmeenergie) umgewandelt.
So ist beispielsweise das Alkan Octan ein wichtiger Bestandteil von Benzin:
- C8H18 (Octan) + 12.5 O2 (Sauerstoff) → 8 CO2 (Kohlenstoffdioxid) + 9 H2O (Wasser)
Bei dieser Reaktion wird das Alkan vom Sauerstoff in der Luft oxidiert. Dabei entsteht das Gas Kohlenstoffdioxid und Wasserdampf. Die freigesetzte Energie treibt zum Beispiel Autos mit einem Verbrennungsmotor an. Die chemische Energie wird zu kinetischer Energie.
Es handelt sich um eine Redox-Reaktion, bei welcher Octan als Reduktions- und Sauerstoff als Oxidationsmittel fungiert.
Aus dem Alltag sind uns verschiedene Brennstoffe bekannt, zum Beispiel Holz und andere Pflanzenmaterialien, Kohle, Diesel, Methangas (Erdgas), Ethanol oder Bienenwachs. Alle diese Stoffe haben einen sehr hohen Kohlenstoffanteil. Brennbar sind also Stoffe in allen Aggregatszuständen – Flüssigkeiten, Festkörper und Gase.
Es ist Aktivierungsenergie erforderlich, um die Reaktion zu starten. So muss dem Holz mit einer Anzündhilfe und einem bereits brennenden Streichholz zunächst Energie zugeführt werden.
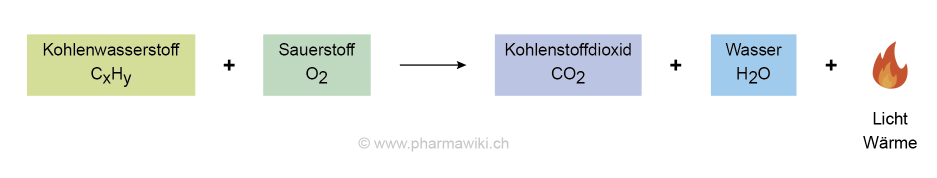
Verbrennung eines Kohlenwasserstoffs, zum Vergrössern anklicken. Illustration © PharmaWiki
Verbrennung von Verbindungen mit anderen ElementenAuch bei der Oxidation anderer chemischer Elemente und Verbindungen wird von einer Verbrennung gesprochen. So verbrennt beispielsweise Schwefel mit einer blauen Flamme unter Bildung des giftigen Schwefeldioxids (SO2):
- S8 (Schwefel) + 16 O2 (Sauerstoff) → 8 SO2 (Schwefeldioxid)
Sogar Metalle können „verbrennen“, zum Beispiel elementares Magnesium:
- 2 Mg: (Magnesium elementar) + O2 (Sauerstoff) → 2 MgO (Magnesiumoxid)
Brennendes Magnesium kann nicht mit Wasser gelöscht werden, weil Magnesium mit Wasser zum ebenfalls brennbaren Wasserstoff reagiert!
Bei der Verbrennung von Wasserstoff entsteht Wasser. Es handelt sich um die sogenannte Knallgasreaktion:
- 2 H2 (Wasserstoff) + O2 (Sauerstoff) → 2 H2O (Wasser)
Auch das Oxidationsmittel muss nicht notwendigerweise Sauerstoff sein – es existieren weitere wie beispielsweise Chlorgas oder Fluor.
Als „stille Verbrennungen“ werden Oxidationen bezeichnet, die langsam oder unbemerkt verlaufen, wie das Rosten von Eisen (Bildung von Eisenoxiden) oder die Energiegewinnung in den Mitochondrien.
Folgen für Gesundheit und UmweltBei Verbrennungen werden mit dem Rauch häufig Gase und Verbindungen freigesetzt, die für den menschlichen Körper und insbesondere die Atemwege gesundheitsschädlich sind. Ein wichtiger Grund dafür ist, dass Verbrennungen häufig unvollständig ablaufen, d.h. es wird beispielsweise Kohlenstoffmonoxid statt Kohlenstoffdioxid gebildet. Weitere Verbindungen sind zum Beispiel Stickoxide, polyzyklische aromatische Kohlenwasserstoffe und Aldehyde. Ein zusätzliches Problem stellt die Bildung des Feinstaubs dar.
Hohen Kohlenstoffmonoxidkonzentrationen können zu einer lebensgefährlichen Vergiftung führen.
Verbrennungen haben schliesslich auch einen negativen Einfluss auf die Umwelt, insbesondere durch die übermässige Bildung von Treibhausgasen wie Kohlenstoffdioxid durch die Verbrennung fossiler Brennstoffe aus Erdöl, Kohle und Erdgas.
siehe auchChemische Reaktionen, Rauchen, Energie, Kalorien, Kohle, Wasserdampf, Kohlenstoffmonoxid, Chemische Experimente, Kohlenwasserstoffe, Asche, Pyrolyse
Literatur- Adler T. Better burning, better breathing: improving health with cleaner cook stoves. Environ Health Perspect. 2010, 118(3), A 124-9 Pubmed

- Fachliteratur
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
PharmaWiki mit Google durchsuchen.