Isomere
 VerbindungenIsomere sind chemische Verbindungen mit derselben Summenformel, aber einer unterschiedlichen Anordnung im Raum. Die zwei wichtigsten Typen sind die Konstitutionsisomere und die Stereoisomere mit den Enantiomeren und den Diastereomeren.Definition
VerbindungenIsomere sind chemische Verbindungen mit derselben Summenformel, aber einer unterschiedlichen Anordnung im Raum. Die zwei wichtigsten Typen sind die Konstitutionsisomere und die Stereoisomere mit den Enantiomeren und den Diastereomeren.DefinitionIsomere sind chemische Verbindungen mit derselben Summenformel (derselben Anzahl Atome), aber einer unterschiedlichen Anordnung im Raum.
KonstitutionsisomereEin Beispiel für Isomere sind die Ethanol (Alkohol) und der Ether Dimethylether. Beide haben die zwar die identische Summenformel C2H6O und die gleiche Molekülmasse von 46.07 g/mol, aber die Atome sind unterschiedlich miteinander verbunden.
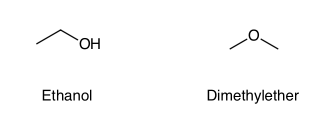
Solche Isomere werden als Konstitutionsisomere (oder Strukturisomere) bezeichnet. Daraus resultieren teilweise sehr unterschiedliche physikochemische Eigenschaften und eine andere Reaktivität. Ethanol und Diemethylether gehören zu zwei verschiedenen Stoffgruppen. Ethanol liegt als Flüssigkeit und Dimethylether als Gas vor. Ein weiteres Beispiel für Strukturisomere ist Butanol und Isobutanol.
TautomereTautomere sind ein Spezialfall der Konstitutionsisomere. Es handelt sich um eine Verbindung, bei welcher ein Wasserstoffatom (H) intramolekular seine Position ändert. Dies wird beispielsweise bei den Aminosäuren beobachtet, bei welchen das H-Atom der Carbonsäure auf die Aminogruppe übertragen werden kann, wodurch ein Zwitterion entsteht. Tautomere stehen in einem Gleichgewicht miteinander und sind schwierig zu trennen.
StereoisomereStereoisomere sind Isomere, bei welchen die Atome zwar gleich miteinander verbunden sind, die sich aber durch die unterschiedliche Anordnung im Raum (Konfiguration) unterscheiden.
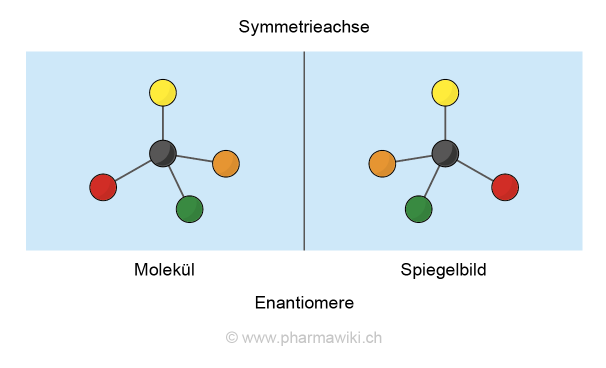
EnantiomereZu den Stereoisomeren gehören erstens die Enantiomere. Bei einem Enantiomerenpaar oder Racemat verhält sich ein Molekül zum anderen wie ein Spiegelbild. Sie zeichnen sich dadurch aus, dass sie nicht zur Deckung gebracht werden können. Sie ähneln einem Paar Handschuhe - der linke Handschuhe passt nicht auf die rechte Hand. Diese Eigenschaft wird als Chiralität („Händigkeit“) bezeichnet. Ein Kohlenstoffatom (C) ist chiral, wenn es vier unterschiedliche Substituenten trägt.
Bild und Spiegelbild können nicht zur Deckung gebracht werden. Zum Vergrössern anklicken. Illustration © PharmaWiki
Chiralität entsteht immer dann, wenn ein Objekt oder Molekül asymmetrisch ist, d.h. wenn es keine Symmetrieebene, -achse oder keinen Symmetriepunkt enthält. Ein geometrischer Würfel verfügt beispielsweise über mehrere Symmetrien und ist daher achiral. Ein Paar Schuhe ist hingegen chiral, weil keine Symmetrien vorliegen und die beiden Schuhe nicht zur Deckung gebracht werden können.
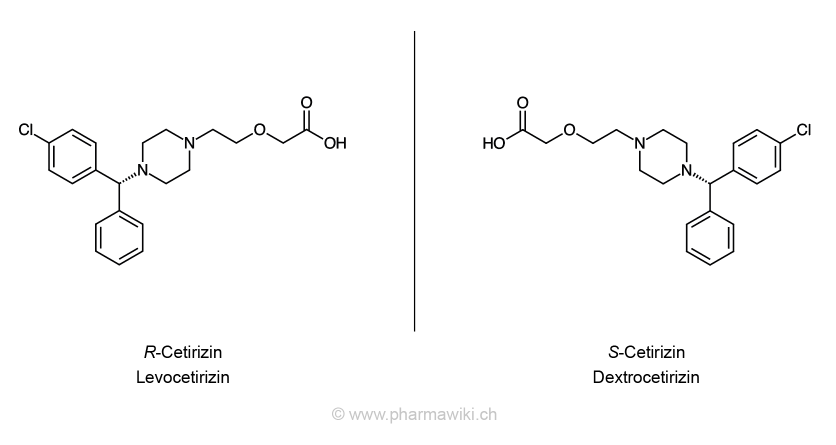
Die Enantiomere Levo- und Dextrocetirizin, zum Vergrössern anklicken. Illustration © PharmaWiki
Viele pharmazeutische Wirkstoffe liegen als reine Enantiomere oder als Racetamate vor. Ausführliche Informationen finden Sie im Artikel Enantiomere.
DiastereomereZu den Stereoisomeren gehören zweitens die Diastereomere. Sie unterscheiden sich von den Enantiomeren dadurch, dass sie nicht als Bild und Spiegelbild vorliegen.
cis-trans-Isomerecis-trans-Isomere entstehen zum Beispiel in Verbindungen mit Doppelbindungen. Wird zum Beispiel bei Ethylen auf beiden Seiten der Doppelbindung ein Wasserstoffatom durch ein Fluor ersetzt, können diese sowohl nach oben als auch nach unten orientiert sein. Zeigen beide Fluoratome nach oben, wird von cis-Isomeren gesprochen (oder Z). Ist ein Fluor nach oben und eines nach unten orientiert, werden sie als trans-Isomere (E) bezeichnet. Z steht für zusammen und E für entgegen.
Der Grund für die Isomerie liegt in der Starrheit der Doppelbindung, welche nicht um die eigene Achse gedreht werden kann. cis-trans-Isomere gehören zu den geometrischen Isomeren.
siehe auchLiteratur- Fachliteratur
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.