Teriparatid
 Arzneimittelgruppen
Arzneimittelgruppen  Parathormon-AnalogaTeriparatid ist ein Wirkstoff aus der Gruppe der Parathormon-Analoga, der für die Behandlung einer Osteoporose mit einem hohen Knochenbruchrisiko eingesetzt wird. Es handelt sich um das aktive und mit biotechnologischen Methoden hergestellte Fragment (1-34) des körpereigenen Parathormons. Im Unterschied zu den anderen Osteoporose-Medikamenten fördert Teriparatid den Aufbau der Knochen und hemmt nicht ihren Abbau. Das Arzneimittel wird von den Patienten einmal täglich subkutan in den Oberschenkel oder die Bauchhaut gespritzt. Zu den häufigsten möglichen unerwünschten Wirkungen gehören Schmerzen, Krämpfe in den Beinen oder im Rücken, Übelkeit und Reaktionen an der Injektionsstelle.
Parathormon-AnalogaTeriparatid ist ein Wirkstoff aus der Gruppe der Parathormon-Analoga, der für die Behandlung einer Osteoporose mit einem hohen Knochenbruchrisiko eingesetzt wird. Es handelt sich um das aktive und mit biotechnologischen Methoden hergestellte Fragment (1-34) des körpereigenen Parathormons. Im Unterschied zu den anderen Osteoporose-Medikamenten fördert Teriparatid den Aufbau der Knochen und hemmt nicht ihren Abbau. Das Arzneimittel wird von den Patienten einmal täglich subkutan in den Oberschenkel oder die Bauchhaut gespritzt. Zu den häufigsten möglichen unerwünschten Wirkungen gehören Schmerzen, Krämpfe in den Beinen oder im Rücken, Übelkeit und Reaktionen an der Injektionsstelle. synonym: Teriparatidum, rhPTH (1-34), Rekombinantes Parathormon (1-34)
ProdukteTeriparatid ist als Injektionslösung in einem vorgefüllten Injektor im Handel (Forsteo®, einige Länder auch: Forteo®). Es wurde in den USA im Jahr 2002 und in der EU und in der Schweiz im Jahr 2003 zugelassen.
Das Arzneimittel muss im Kühlschrank gelagert werden und darf nicht eingefroren werden. Biosimilars sind in vielen Ländern und auch in der Schweiz zugelassen.
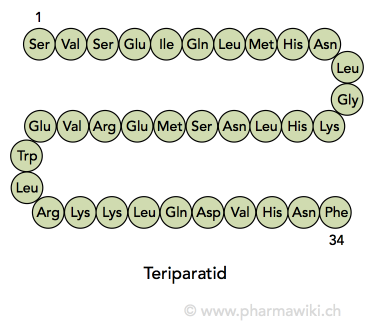
Struktur und EigenschaftenTeriparatid ist ein rekombinantes Polypeptid, das aus den ersten 34 Aminosäuren des körpereigenen Parathormons besteht (1-34). Es handelt sich um das aktive Fragment mit einer Molekülmasse von 4117.8 g/mol (4.1 kDa).
Teriparatid wird mit biotechnologischen Methoden hergestellt. Das natürliche Parathormon wird von der Nebenschilddrüse gebildet und besteht aus 84 Aminosäuren. Es hat einen zentralen Einfluss auf den Calcium- und Phosphathaushalt.
Teriparatid (ATC H05AA02  ) hat knochenaufbauende (anabole) Eigenschaften durch eine direkte Stimulation der Osteoblasten. Dies im Unterschied zu den anderen Arzneimitteln für die Behandlung einer Osteoporose, welche den Knochenabbau hemmen.
) hat knochenaufbauende (anabole) Eigenschaften durch eine direkte Stimulation der Osteoblasten. Dies im Unterschied zu den anderen Arzneimitteln für die Behandlung einer Osteoporose, welche den Knochenabbau hemmen.
Die Effekte entsprechen denjenigen des Parathormons. Teriparatid erhöht die Absorption von Calcium im Verdauungstrakt und fördert die Calcium-Reabsorption an der Niere. Durch die Therapie wird die Knochenmineraldichte erhöht und das Bruchrisiko gesenkt. Die Wirkungen beruhen auf der Bindung an PTH-(GPCR)-Rezeptoren auf der Zelloberfläche.
IndikationenFür die Behandlung der Osteoporose mit einem hohen Risiko für Brüche:
- Bei postmenopausalen Frauen mit manifester Osteoporose und hohem Frakturrisiko.
- Bei Männern mit primärer oder hypogonadaler Osteoporose mit hohem Frakturrisiko.
- Behandlung der Glucocorticoid-induzierten Osteoporose bei Erwachsenen mit erhöhtem Frakturrisiko.
Off-Label wird Teriparatid auch für die Förderung der Heilung von Knochenbrüchen verwendet, hat dafür aber keine Zulassung.
DosierungGemäss der Fachinformation. Das Arzneimittel wird einmal täglich subkutan in den Oberschenkel oder in die Bauchhaut gespritzt. Die Patienten führen die Injektion nach einer Instruktion durch das Fachpersonal selbst durch. Die ersten Verabreichungen sollten im Sitzen oder Liegen erfolgen.
Eine Therapiedauer von zwei Jahren wurde untersucht und soll nicht überschritten werden. Im Anschluss können andere Osteoporose-Medikamente verabreicht werden.
Bei einer unzureichenden Versorgung sollen Calcium und Vitamin D supplementiert werden.
KontraindikationenZu den Gegenanzeigen gehören (Auswahl):
- Überempfindlichkeit
- Hyperkalzämie
- Schwere Beeinträchtigung der Nierenfunktion
- Schwangerschaft, Stillzeit
- Vorausgegangene Strahlentherapie
- Kinder und Jugendliche
Die vollständigen Vorsichtsmassnahmen finden sich in der Arzneimittel-Fachinformation.
InteraktionenTeriparatid soll nur mit Vorsicht mit Digoxin kombiniert werden, weil in Einzelfällen vermehrt unerwünschte Wirkungen auftreten können.
Unerwünschte WirkungenZu den häufigsten möglichen unerwünschten Wirkungen gehören Schmerzen, Krämpfe in den Beinen oder im Rücken, Übelkeit und Reaktionen an der Injektionsstelle. Der Serumcalciumspiegel kann vorübergehend erhöht werden.
Bei Versuchen mit Ratten wurde eine erhöhte Inzidenz von malignen Knochentumoren, sogenannten Osteosarkomen, festgestellt. Für den Menschen besteht gemäss einer langjährigen Postmarketingstudie aber kein oder nur ein extrem kleines Risiko (z.B. Andrews et al., 2012).
siehe auchLiteratur- Andrews E.B. et al. The US postmarketing surveillance study of adult osteosarcoma and teriparatide: study design and findings from the first 7 years. J Bone Miner Res, 2012, 27(12), 2429-37 Pubmed

- Arzneimittel-Fachinformation (CH, EMA, USA)
- Blick S.K., Dhillon S., Keam S.J. Teriparatide: a review of its use in osteoporosis. Drugs, 2008, 68(18), 2709-37 Pubmed

- Bodenner D., Redman C., Riggs A. Teriparatide in the management of osteoporosis. Clin Interv Aging, 2007, 2(4), 499-507 Pubmed

- Eastell R., Walsh J.S. Anabolic treatment for osteoporosis: teriparatide. Clin Cases Miner Bone Metab, 2017, 14(2), 173-178 Pubmed

- File E., Deal C. Clinical update on teriparatide. Curr Rheumatol Rep, 2009, 11(3), 169-76 Pubmed

- Shi Z. et al. Effectiveness of Teriparatide on Fracture Healing: A Systematic Review and Meta-Analysis. PLoS One, 2016, 11(12), e0168691 Pubmed

Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
Weitere Informationen