Peroxide
 StoffgruppenPeroxide sind organische oder anorganische Verbindungen mit der chemischen Struktur R1-O-O-R2 oder mit dem Peroxidanion O22−. Der einfachste und bekannteste Vertreter ist Wasserstoffperoxid. Peroxide zeichnen sich durch ihre Instabilität und Reaktivität aus. Sie haben bleichende, desinfizierende und oxidierende Eigenschaften und werden unter anderem als Desinfektionsmittel, gegen Akne, Malaria und als Reagenzien verwendet. Peroxide können für die illegale Herstellung von Explosivstoffen missbraucht werden.
StoffgruppenPeroxide sind organische oder anorganische Verbindungen mit der chemischen Struktur R1-O-O-R2 oder mit dem Peroxidanion O22−. Der einfachste und bekannteste Vertreter ist Wasserstoffperoxid. Peroxide zeichnen sich durch ihre Instabilität und Reaktivität aus. Sie haben bleichende, desinfizierende und oxidierende Eigenschaften und werden unter anderem als Desinfektionsmittel, gegen Akne, Malaria und als Reagenzien verwendet. Peroxide können für die illegale Herstellung von Explosivstoffen missbraucht werden.synonym: Peroxyde
DefinitionPeroxide sind organische oder anorganische Verbindungen mit der allgemeinen chemischen Struktur R1-O-O-R2. Der einfachste und bekannteste Vertreter ist Wasserstoffperoxid (H2O2): H-O-O-H.
Peroxide können auch das Peroxidanion O22− enthalten, zum Beispiel Lithiumperoxid: Li2O2.
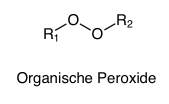
Die Trivialnamen der Peroxide werden häufig mit dem Suffix -peroxid oder dem Präfix Per- gebildet.
VertreterEine Auswahl von Peroxiden:
- Artemether
- Benzoylperoxid
- Dibenzoylperoxid
- Peressigsäure
- Wasserstoffperoxid

Die Peroxide sind reaktiv, weil die Bindung zwischen den Sauerstoffatomen (-O-O-) schwach ist. Peroxide sind starke Oxidationsmittel, welche Sauerstoff zum Beispiel für Verbrennungen oder andere chemische Reaktionen zur Verfügung stellen.
In der PharmaziePeroxide werden in der Pharmazie und Medizin unter anderem als Desinfektionsmittel, als Bleichmittel, gegen Akne, Malaria (Artemether) und als Reagenzien verwendet.
MissbrauchPeroxide können für die Herstellung illegaler Explosivstoffe missbraucht werden. Aus Aceton kann mit Wasserstoffperoxid das instabile und explosive Acetonperoxid (APEX) hergestellt werden, das in der Vergangenheit für mehrere Terroranschläge missbraucht wurde.
Literatur- Arzneimittel-Fachinformation
- Fachliteratur
- IUPAC
- Lehrbücher der Chemie
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.
PharmaWiki mit Google durchsuchen.
