Verdünnungen
 PharmaWikiBei Verdünnungen wird der Gehalt einer Substanz oder eines Gemischs verringert. Sie sind in der Pharmazie für die Arneimittelherstellung von grosser Bedeutung. Mit einer einfachen Formel lassen sich viele Verdünnungen leicht berechnen.
PharmaWikiBei Verdünnungen wird der Gehalt einer Substanz oder eines Gemischs verringert. Sie sind in der Pharmazie für die Arneimittelherstellung von grosser Bedeutung. Mit einer einfachen Formel lassen sich viele Verdünnungen leicht berechnen. synonym: Dilutionen, Dilutio, Dil
DefinitionAls Verdünnung wird die Verringerung der Konzentration von Substanzen und Gemischen bezeichnet. Verdünnungen sind in der Pharmazie vor allem für flüssige und halbfeste Arzneiformen gebräuchlich und spielen bei der Herstellung eine wichtige Rolle. Auch feste Arzneiformen wie Pulver können verdünnt werden.
Für ein optimales Verständnis dieses Themas empfehlen wir zusätzlich die PharmaWiki-Artikel Masse, Volumen, Konzentration und Dichte.
Als Gegenteil einer Verdünnung wird in der Chemie das Einengen bezeichnet.
DurchführungIn der Regel wird bei einer Verdünnung Lösungsmittel oder Grundlage hinzugefügt. Weil das Volumen und die Masse dadurch zunimmt, sinkt die Konzentration. Im folgenden Beispiel mit einer Massenkonzentration ist das Volumen V der Divisor. Steigt V an, sinkt die Konzentration:
- C (Massenkonzentration) = m (Masse) / V (Volumen)
Der Berechnung von Verdünnungen liegt das Prinzip zugrunde, dass die Menge oder die Anzahl der gelösten oder dispergierten Substanz vor und nach der Verdünnung gleich bleibt. Gibt man beispielsweise Wasser zu einem Sirup, verändert sich dadurch die Menge des gelösten Zuckers nicht.
Am Beispiel der Stoffmengenkonzentration:
- C (Stoffmengenkonzentration) = n (Stoffmenge) / V (Volumen)
Also gilt:
- n = C x V
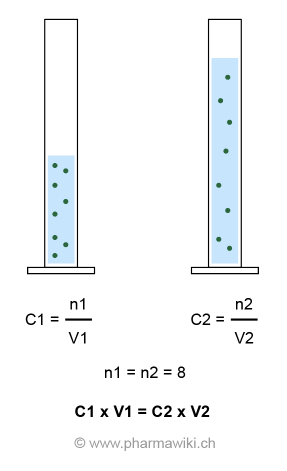
Die Stoffmenge der Substanz ist vor (n1) und nach der Verdünnung (n2) gleich:
- n1 = n2
Also gilt:
- C1 (Konzentration 1) x V1 (Volumen 1) = C2 (Konzentration 2) x V2 (Volumen 2)
Dabei handelt es sich um die bekannte Formel, die im Zusammenhang mit Verdünnungen häufig verwendet wird.
Auch bei einer Massenkonzentration kommt diese Formel zur Anwendung:
- C (Massenkonzentration) = m (Masse) / V (Volumen)
Die Masse ist vor und nach der Verdünnung gleich:
- m1 = m2
Demnach gilt auch hier:
- C1 x V1 = C2 x V2
Beim Massenprozent wird das Volumen durch die Gesamtmasse ausgetauscht:
- C1 x m1 = C2 x m2
Auf dieser Formel beruhen Merksätze wie „Kunde mal Kunde durch Apotheker“ (Arzt mal Arzt durch Apotheke) und „I will i will i han“. Dabei wird die konzentrierte Masse m1 berechnet, welche für die Verdünnung benötigt wird:
- m1 = (C2 x m2) / C1
- m1 = (Kunde x Kunde) / Apotheker
- m1 = (I will x I will) / I han
Beispiel: Eine Kundin bestellt 100 g Salicylvaseline 10 %. In der Apotheke ist Salicylvaseline 50 % vorrätig. Wie viel der konzentrierten Salbe wird für die Herstellung benötigt?
Lösung:
- m1 = (10 % x 100 g) / 50 % = 20 g
Für die Zubereitung wird 20 g Salicylvaseline 50 % (m1) mit 80 g Vaseline gemischt. Dies ergibt zusammen 100 g Salicylvaseline 10 % (m2).
Verdünnungsrechner:
Link: Verdünnungsrechner des PharmaWiki 
Komplizierter wird es beim Rechnen mit Volumenprozenten. Ein typisches Beispiel ist die Alkoholverdünnung. Hier kann unsere oben dargestellte Verdünnungsformel (C1 x V1 = C2 x V2) nicht direkt zur Anwendung kommen.
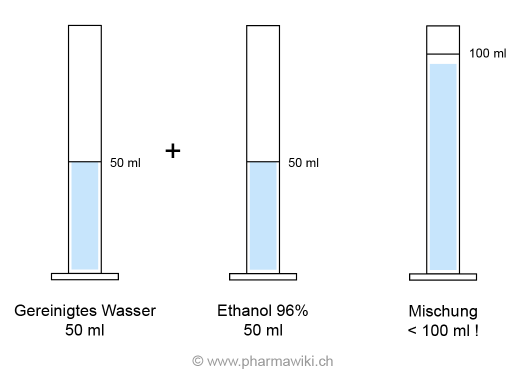
Werden 50 ml Wasser mit 50 ml Wasser gemischt, ist das Resultat 100 ml Wasser.
Werden aber 50 ml Wasser mit 50 ml Ethanol 96 % (V/V) gemischt, ist die Summe nicht 100 ml, sondern merklich weniger! Dieses Phänomen wird als Volumenkontraktion bezeichnet.
Mit den Volumen kann deshalb nicht gerechnet werden.
Aber mit den Massen, denn sie verändern sich nicht, auch nicht bei einem unterschiedlichen Druck.
Für die Berechnung von Alkoholverdünnungen müssen deshalb sowohl die Volumen als auch die Volumenprozente in Massen resp. Massenprozente umgerechnet werden. Eine ausführliche Ethanoltabelle mit den benötigten Angaben befindet sich im europäischen Arzneibuch.
Mit Ethanol 96 % (V/V) und gereinigtem Wasser sollen 100 ml Ethanol 20% (V/V) hergestellt werden. Wie viel Ethanol und Wasser werden dafür benötigt? Die Temperatur legen wir auf 20°C fest.
Wie bereits erwähnt müssen die Volumenprozente und Volumen in Massenprozente und Massen umgerechnet werden. Dafür steht die Ethanoltabelle des europäischen Arzneibuchs zur Verfügung, in welcher die Dichten und die Massenprozente aufgeführt sind.
- Ethanol 96 % (V/V) entspricht 93.84 % (m/m) und hat eine Dichte von 0.80742 g/cm3.
- Ethanol 20 % (V/V) entspricht 16.21 % (m/m) und hat eine Dichte von 0.97356 g/cm3.
- Für Wasser rechnen wir mit einer Dichte von 1 g/cm3.
Es gilt:
- Masse = Dichte x Volumen
Also:
- Zielgrösse: 100 ml Ethanol 16.21 % (m/m) = 0.97356 g/cm3 x 100 ml = 97.356 g
Berechnung der Verdünnung mit unserer Formel für Massenprozente (siehe oben):
- m1 = (C2 x m2) / C1 = (16.21 % x 97.356 g) / 93.84 % = 16.82 g Ethanol 96 %
Lösung: 16.82 g Ethanol 96 % werden auf der Waage mit Wasser auf 97.356 g ergänzt.
Tipp: Im Formularium Helveticum (FH) findet sich eine Tabelle mit den berechneten Werten für die verschiedenen Alkoholverdünnungen. Im Internet gibt es digitale Alkoholverdünnungsrechner.
WasserstoffperoxidWasserstoffperoxid wird in Apotheken ebenfalls häufig verdünnt. Es ist im europäischen Arzneibuch mit Massenprozent monographiert:
- Wasserstoffperoxid 30 % (m/m)
- Wasserstoffperoxid 3 % (m/m)
Wasserstoffperoxid kann also auf der Waage verdünnt werden. Die Dichte von Wasserstoffperoxid (30 %) ist mit 1.1 g/cm3 leicht höher als diejenige von Wasser.
siehe auchMasse, Volumen, Konzentration und Dichte, Einengen
Literatur- Europäisches Arzneibuch PhEur
- Fachliteratur
- Formularium Helveticum
- Lehrbücher der Chemie
- Lehrbücher der pharmazeutischen Technologie
- PharmXplorer.at
- Sicherheitsdatenblatt
Interessenkonflikte: Keine / unabhängig. Der Autor hat keine Beziehungen zu den Herstellern und ist nicht am Verkauf der erwähnten Produkte beteiligt.